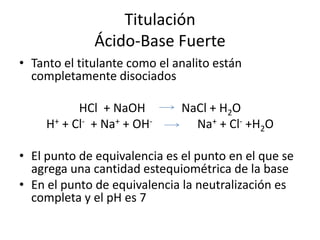
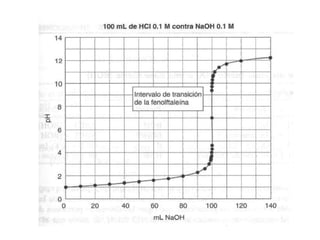
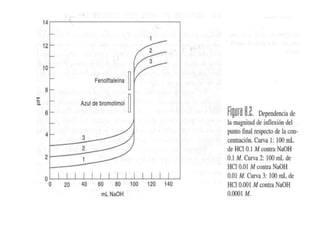
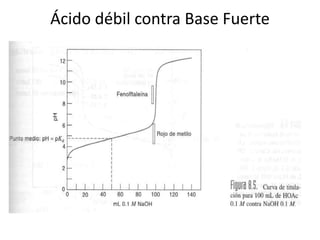
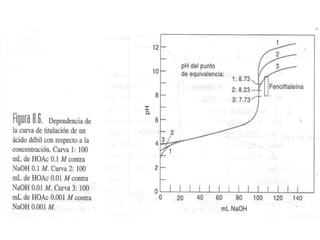
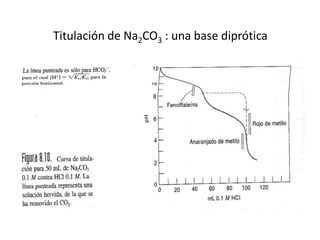
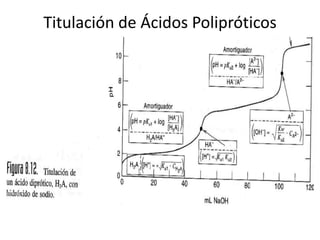
El documento describe diferentes tipos de titulaciones ácido-base. Explica que una titulación ácido-base fuerte resulta en un punto de equivalencia a pH 7, mientras que una titulación de ácido débil contra base fuerte o viceversa resulta en un punto de equivalencia dependiente del pKa. También cubre titulaciones que involucran ácidos o bases dipróticos, donde ocurren múltiples puntos de equivalencia a diferentes pHs. Finalmente, menciona el uso de indicadores para detectar visualmente los puntos finales en las titulaciones.