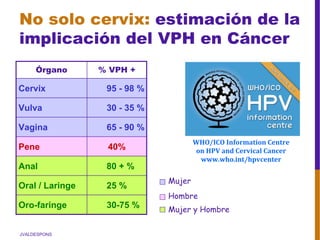
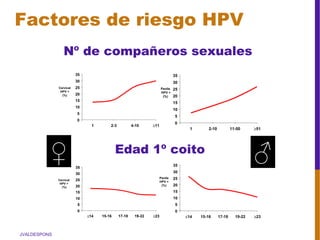
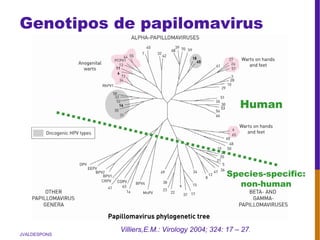
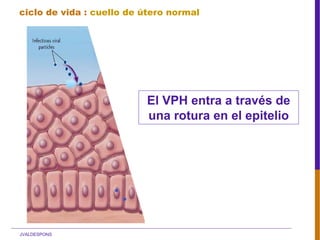
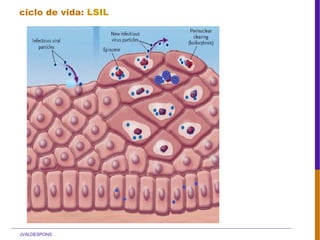
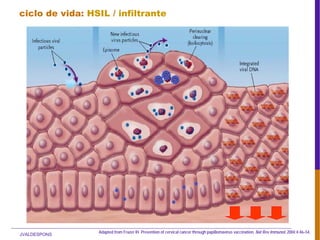
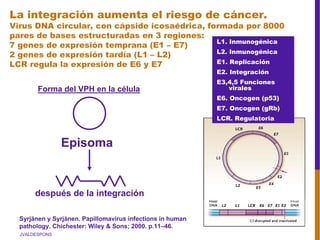
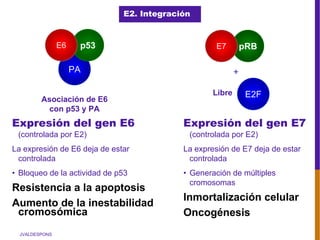
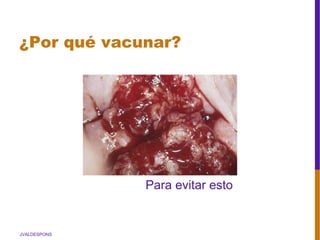
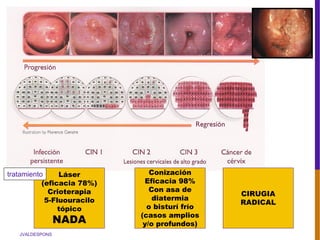
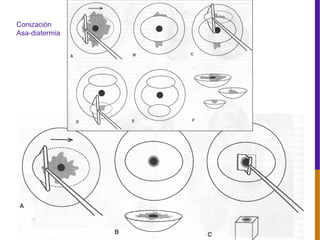
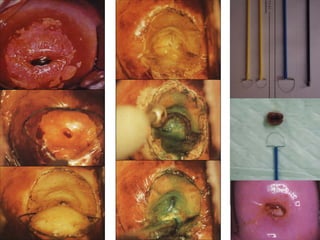
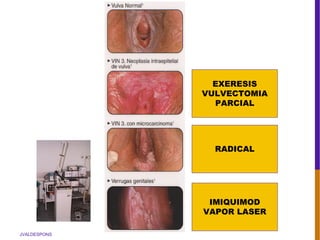
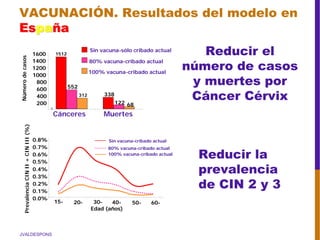
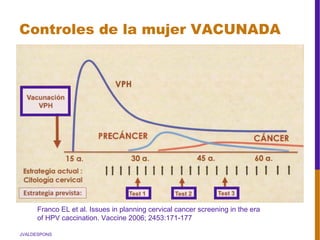
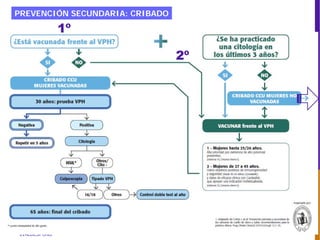
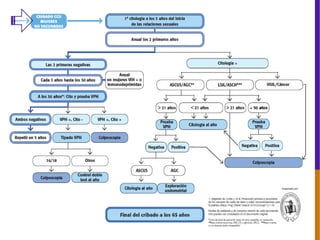
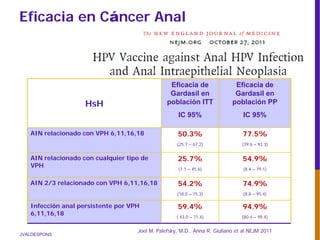
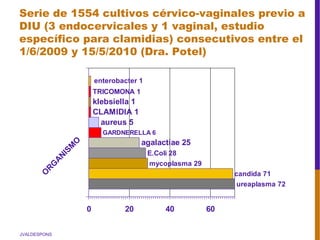
El documento describe la importancia del virus del papiloma humano (VPH) y su asociación causal con el cáncer de cuello uterino. Resalta que el 80% de la población mundial tendrá contacto con el VPH y que la vacunación puede prevenir numerosos casos de cáncer de cuello uterino y verrugas genitales.