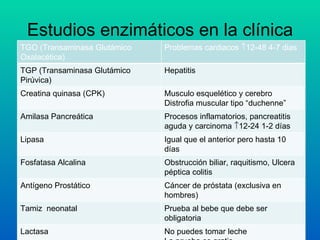
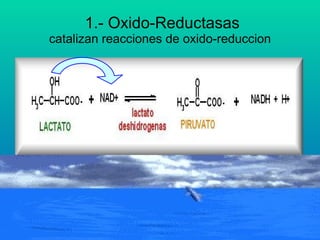
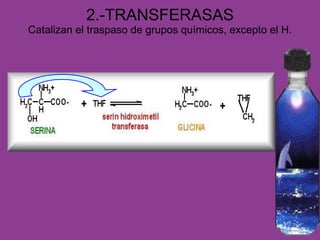
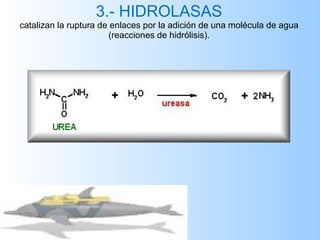
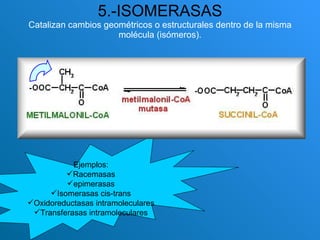
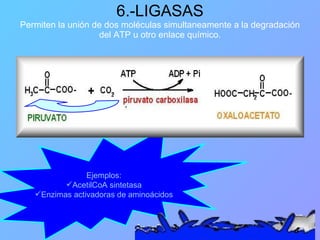
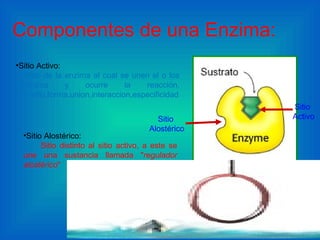
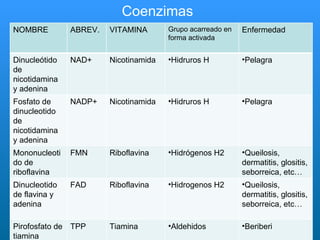
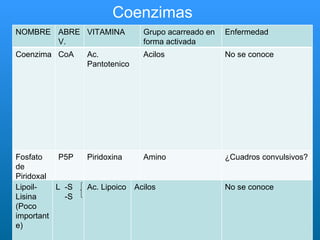
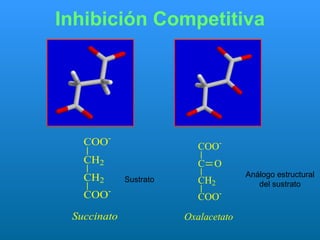
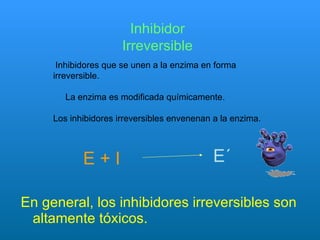
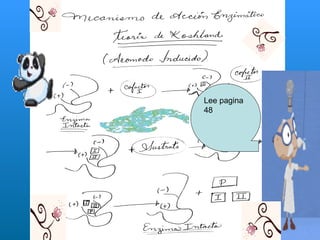
El documento habla sobre las enzimas, sus características y clasificación. Explica que las enzimas son catalizadores biológicos de naturaleza proteica que aceleran las reacciones químicas sin modificar el equilibrio. Se clasifican en oxidorreductasas, transferasas, hidrolasas, liasas, isomerasas y ligasas. También describe los componentes de un sistema enzimático como sustratos, productos e inhibidores, y los tipos de inhibición enzimática.




















![1913: Relación entre [ S ] y la velocidad de reacción. El paso limitante en una reacción enzimática es el rompimiento del complejo ES en producto y enzima libre. Ecuación de Michaelis - Menten V i](https://image.slidesharecdn.com/enzimaseduardo-100121212336-phpapp01/85/Enzimas-32-320.jpg)
![Vi = velocidad inicial Vmax = velocidad máxima Curva Hiperbólica En V i : [P] es mínima [S] es elevada [S] >>> [E] V i A B C](https://image.slidesharecdn.com/enzimaseduardo-100121212336-phpapp01/85/Enzimas-33-320.jpg)
![Vi = velocidad inicial Vmax = velocidad máxima Curva Hiperbólica En V i : [P] es mínima [S] es elevada [S] >>> [E] La velocidad de la reacción aumenta linealmente con el aumento de la [S]. Al aumentar la [S], la enzima se satura y alcanza su velocidad máxima (Vmax), la cual ya no se incrementará, por más que aumente la [s]. V i aumenta hasta alcanzar V max Si: [S] aumenta y V i no aumenta E está saturada con S Vmax V i A B C V i A B C](https://image.slidesharecdn.com/enzimaseduardo-100121212336-phpapp01/85/Enzimas-34-320.jpg)
![A C B Cuando [S] <<< Km: V i [S]. Cuando [S] >>> Km: La velocidad de reacción es máxima e invariable, aunque se incremente aún más [S]. Cuando [S] = Km : Vi = ½ Vmax Km en la cinética enzimática V i A B C](https://image.slidesharecdn.com/enzimaseduardo-100121212336-phpapp01/85/Enzimas-35-320.jpg)