Ejercicios para el tercer examen parcial
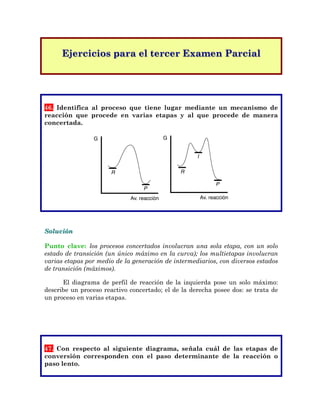
- 1. Ejercicios para el tercer Examen Parcial 46. Identifica al proceso que tiene lugar mediante un mecanismo de reacción que procede en varias etapas y al que procede de manera concertada. Solución Punto clave: los procesos concertados involucran una sola etapa, con un solo estado de transición (un único máximo en la curva); los multietapas involucran varias etapas por medio de la generación de intermediarios, con diversos estados de transición (máximos). El diagrama de perfil de reacción de la izquierda pose un solo máximo: describe un proceso reactivo concertado; el de la derecha posee dos: se trata de un proceso en varias etapas. 47. Con respecto al siguiente diagrama, señala cuál de las etapas de conversión corresponden con el paso determinante de la reacción o paso lento. G Av. reacción R P G Av. reacción R P I
- 2. 2 Solución Punto clave: la mayor energía de activación en un proceso multietapas corresponde con el paso lento. Determina las magnitudes de las energías de activación de las diferentes etapas: Ahora compara sus valores: G Avance de reacción R I1 I2 P G Avance de reacción R I1 I2 P ΔG1 ≠ ΔG2 ≠ ΔG3 ≠
- 3. 3 Queda claro que ΔG1 ≠ posee el mayor valor, por lo que esta etapa, la de los reactivos R a la formación del intermediario I1, será el paso determinante de la reacción (lo que más trabajo le cuesta energéticamente y, por tanto, la etapa que transcurrirá más lentamente). 48. En un libro de texto encuentras que para las siguientes reacciones: y se menciona que k1/k2 = 80 000. ¿Qué se puede decir acerca de la rapidez con la que transcurren ambos proicesos y del rendimiento con el que proceden? Solución Punto clave: las constantes k describen la reactividad cinética únicamente; nada se puede decir acerca de la reactividad termodinámica. La relación k1/k2 = 80 000 indica que el proceso representado arriba es ochentamil veces más rápido que el segundo (reactividad cinética). Por otra parte, a partir de estos únicos datos no se puede decir absolutamente nada acerca de si uno u otro posee con mayor eficiencia de conversión, o lo que es lo mismo, cual posee mayor rendimiento en la formación de su respectivo producto (reactividad termodinámica). ΔG1 ≠ ΔG2 ≠ ΔG3 ≠
- 4. 4 49. Considera las siguientes reacciones (por el momento, no hagas caso a las cargas eléctricas representadas): ¿Cuál de las dos reacciones presenta una ley de rapidez de reacción del tipo r = k[A][B] y cuál una tipo r = k[A]? Solución Punto clave: Las especies químicas que se encuentran presentes en los reactivos y en los productos en el paso lento de la reacción no inciden en la estructura de la ley de rapidez de reacción. En la primera reacción el amoniaco NH3 y el borano BH3 se transforman íntegramnente en el producto que se señala; ninguno de ellos acompña al producto, por lo que cinéticamente la reacción depende de ambos reactivos; la ley de rapidez de reacción de este proceso será tipo r = k[NH3][BH3], lo que indica que el aumento en la concentración de cualquiera de ambos reactivos hará que la rapidez de conversión aumente; por el contrario, si se disminuye la concentración de cualquiera de ellos, el proceso tendrá lugar más lentamente. En el caso de la segunda reacción, debemos considerar para efectos cinéticos lo que pasa en el paso lento, que como tal se señala, es el primero. En él, sólo el CoCl4 sufre una transformación (a CoCl3), mientras que el NH3 no sufre en esta etapa modificación alguna; por tanto, la ley de rapidez de reacción es r = k[CoCl4], puesto que depende únicamente de la descomposición del compuesto de cobalto. H N H H B H HH N B H H H H H H Cl Co Cl Cl Cl H N H H Cl Co Cl ClH N H H lento Cl rápido H3N Co Cl Cl Cl Cl
- 5. 5 50. Considera los siguientes procesos: N2(g) + 3 F2(g) → 2 NF3(g) ΔH0 = - 249 kJ/mol, ΔS0 = - 278 J/mol N2(g) + 3 Cl2(g) → 2 NCl3(g) ΔH0 = + 460 kJ/mol, ΔS0 = - 275 J/mol N2F4(g) → 2 NF2(g) ΔH0 = + 93 kJ/mol, ΔS0 = + 198 J/mol Determina bajo que condiciones de temperatura será espontáneo cada uno de estos procesos Punto clave: Una reacción se encontrará favorecida termodinámicamente, esto es, será espontánea, ΔG0 Ü (–), si a ella contribuye una tendencia negativa en el cambio de entalpía, ΔH0 Ü (–)], y una positiva en el cambio de la entropía, ΔS0 Ü (+). Solución El proceso N2(g) + 3 F2(g) → 2 NF3(g) se encuentra favorecido entálpicamente [ΔH0 Ü (–)] pero no entrópicamente [ΔS0 Ü (–)]; dado que los factores entrópicos sí influyen con respecto a la temperatura, en este caso habrá que minimizarlos paravque el proceso tenga lugar. por lo tanto, podemos esperar que esta reacción sea espontánea (es decir, proceda sin ninguna ayuda externa) a temperatura baja. Nota cultural: la entropía del sistema disminuye su valor porquede cuatro moles de reactivos gaseosos en los reactivos se generan únicamente dos moles de productos gaseosos; esta caída en el número de moles de gas está de acuerdo con un abatimiento de los grados de libertas del sistema y, por tanto, de una disminución del contenido entrópico del sistema. El proceso N2(g) + 3 Cl2(g) → 2 NCl3(g) se encuentra desfavorecido tanto entálpica [ΔH0 Ü (+)] como entrópicamente [ΔS0 Ü (–)], por lo que no procederá bajo ninguna condición de temperatura, a menos que se reciba energía del exterior. Como tal, el que sí estaría favorecido sería el proceso inverso, esto es, 2 NCl3(g) → N2(g) + 3 Cl2(g). Finalmente, el proceso N2F4(g) → 2 NF2(g) se encuentra desfavorecido entálpicamente [ΔH0 Ü (+)] pero no entrópicamente [ΔS0 Ü (+)], por lo que será necesario imponer una temperatura elevada para que pueda tener lugar.
- 6. 6 51. Determina el ΔHº de combustión del butano Punto clave: Los enlaces que se rompen contribuyen positivamente al cambio de entalpía de una reacción; los que se forman lo hacen de manera negativa. Solución Consulta los valores que necesitas de entalpías o energías de enlace de una Tabla como ésta: H C H H C C H H H C H H H H 2 + O O13 O C O8 + H O H10
- 7. 7 Con respecto a los enlaces que se romperán en el propano, hacemos el siguiente análisis: 2 moles × 10 × 414 kJ/mol = + 8280 kJ (enlaces C-H) 2 moles × 3 × 347 kJ/mol = + 2082 kJ (enlaces C-C) Con respecto a los que se romperán en el O2: 13 moles × 1 × 498.7 kJ/mol = + 6483.1 kJ (enlace O=O) Con respecto a los que se formarán en el CO2: 8 moles × 2 × 799 kJ/mol = – 12784 kJ (enlace C=O en específico para el CO2) Con respecto a los que se formarán en el H2O: 10 moles × 2 × 460 kJ/mol = – 9200 kJ (enlace H-O) El ΔH0 de la reacción se calcula como sigue: + 8280 kJ + 2082 kJ + 6483.1 kJ – 12784 kJ – 9200 kJ = – 5138.9 kJ Ésta es la energía que se libera cuando dos moles de butano se queman con oxígeno. El calor de combustión se calcula entonces considerando el numero de moles que de esta sustancia intervienen en esta ecuación: ΔHºc (butano) = – 5138.9 kJ/2 moles = – 2569.45 kJ/mol Nota cultural: los calores de combustión teóricos difieren de los reales hasta en un 10 %. Por ejemplo, el calor de combustión estándar para el propano obtenido de tablas es de – 2877 kJ/mol, lo que representa un error del 10.6 %. 52. Representa la expresión que define las constantes de acidez del ácido fosfórico. H C H H C C H H H C H H H H 2 H C H H C C H H H C H H H H 2 O O13 O C O8 H O H10 H O P O O O H H
- 8. 8 Punto clave: las constantes de acidez relacionan, como cualquier otra constante de equilibrio, la concentración que alcanzan los productos y los reactivos en el equilibrio, esto es, cuando después de que ya ha pasado todo el tiempo que haga falta, la conversión se detiene y no se registran más cambios. Bajo estas circunstancias, será imposible obtener trabajo de un sistema así. Solución Primera constante de disociación: 𝐾!! = H! H!PO! ! H!PO! Segunda constante de disociación: 𝐾!! = H! HPO! !! H!PO! !! Tercera constante de disociación: 𝐾!! = H! PO! !! HPO! !! Nota cultural: un ácido con varios protones que pueden ser cedidos se denomina poliprótico. Debe tenerse en cuenta que conforme la estructura se va desprotonando, la base conjugada resultante va soportando una mayor carga negativa, lo que le resta estabilidad a la especie (y fortaleza como base). Así pues, los calores de Ka sucesivos van disminuyendo su magnitud, lo que está de acuerdo con su tendencia cada vez menor a ceder protones. En el caso del H3PO4, 𝐾! = 7.08 × 10!! ; 𝐾! = 6.31 × 10!! ; 𝐾! = 4.17 × 10!!" . 53. En un manual de Química se señala que el valor del pKa del HF es de 3.16. Obtén el valor de la constante de acidez Ka. H O P O O O H H H O P O O O H + H H O P O O O H O P O O O H + H O P O O O H O P O O O + H
- 9. 9 Punto clave: considera la relación pKa = - log Ka. El logaritmo es base 10. Solución La Ka del HF se calcula a partir del valor de su pKa como sigue: p𝐾! = 3.16 𝐾! = 10!!.!" 𝐾! = 6.92 × 10!! = H! [F! ] [HF] 54. La cafeína es un compuesto básico. Representa la manera en a que se protona, así como la expresión de equilibrio químico que define su valor de Kb. Considera que el único átomo de nitrógeno que se encuentra en posibilidades de ser protonado en condiciones normales es el que se indica en rojo. Punto clave: protona el nitrógeno que se te está indicando; en cuanto a la expresión, en el denominador va la concentración de los productos que se alcanza en el equilibrio y en el denominador la de los reactivos. Solución N N N N O O CH3 CH3 CH3
- 10. 10 𝐾! = !C!H!!N!O!" ! ! !C!H!"N!O!"![H! ] 55. Identifica de las sustancias que conforman la siguiente reacción, la cual procede espontáneamente en el sentido en el que indica la flecha, al acido, la base, el ácido conjugado y la base conjugada en el sentido de la teoría de Brønsted-Lowry. Punto clave: Siempre los ácidos y bases fuertes dan los ácidos y bases débiles; estos últimos serán los llamados conjugados. La flecha se origina del lado donde se encuentran los fuertes. Solución Los ácidos y bases fuertes serán los denominados “reactivos” en una reacción ácido-base en el sentido de Brønsted-Lowry; en los “productos” se encontrarán los pares conjugados. El ácido conjugado poseerá un protón de más en su estructura con respecto a los existentes en la especie definida como la base, y lo inverso ocurre con el sistema ácido-base conjugada. N N N N O O CH3 CH3 CH3 H N N N N O O CH3 CH3 CH3 H C8H10N4O2 C8H11N4O2 + O O Na H Br + O O Na Br H +
- 11. 11 56. ¿En que sentido el siguiente equilibrio químico es espontáneo? El pKa del HF = 3.16 Punto clave: sólo los ácidos y bases que poseen constante de acidez son débiles. Solución El pKa del ácido fluorhídrico, HF, tiene un valor de 3.16, lo que deja claro es que se trata de un ácido débil, y será deficiente para transferir su protón; por otra parte, el HClO4, ácido perclórico, es uno de los seis reconocidos como fuertes, con una capacidad muy elevada de protonar sustancias. Por lo tanto, la reacción será espontánea en el sentido en el que el HClO4 se desprotone, esto es, con respecto a la ecuación química anterior, de izquierda a derecha: O O Na H Br + O O Na Br H + ácido base conjugada base ácido conjugado H F + O Cl O O O F + H O Cl O O O H F + O Cl O O O F + H O Cl O O O
- 12. 12 57. ¿En que sentido el siguiente equilibrio químico es espontáneo? El pKa del H2S = 7.01; pKa del HNO2 = 3.14. Punto clave: a medida que la constante de basicidad, Kb, aumenta, el ácido se vuelve más fuerte, esto es, aumentará su capacidad para ceder el protón y protonar. Considerando pKa = –log Ka o Ka = 10–pKa, a medida que pKa disminuye, el ácido se hace también más fuerte. Solución pKa del H2S = 7.01 (Ka = 10–7.01 = 9.77 x 10–8); pKa del HNO2 = 3.14 (Ka = 7.24 x 10–4). Esto nos permite concluir que el HNO2 es más fuerte, por lo que deberá formar parte de los reactivos. La reacción anterior por tanto será espontánea en el sentido siguiente: 58. ¿En que sentido el siguiente equilibrio químico es espontáneo? El pKb de la etilamina (CH3CH2NH2) = 3.19; pKa de la piridina (C5H5N) = 8.76. Punto clave: a medida que la constante de basicidad, Kb, aumenta, la base se vuelve más fuerte, esto es, aumentará su capacidad para capturar un protón y permanecer protonada. Considerando pKb = –log Kb o Kb = 10–pKb, a medida que pKb disminuye, la base se hace también más fuerte. Solución pKb de la CH3CH2NH2 = 3.19 (Kb = 10–7.01 = 6.46 x 10–4); pKb de la C5H5N = 8.76 (Kb = 1.74 x 10–9). Esto nos permite concluir que la CH3CH2NH2 es más fuerte, por lo que deberá formar parte de los reactivos. La reacción anterior por tanto será espontánea en el sentido siguiente: H S + H O N OH S + O N OH H S + H O N OH S + O N OH CH3CH2NH2 + C5H5NH CH3CH2NH3 + C5H5N
- 13. 13 CH3CH2NH2 + C5H5NH CH3CH2NH3 + C5H5N
