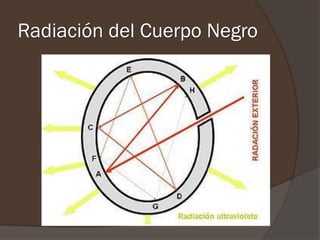
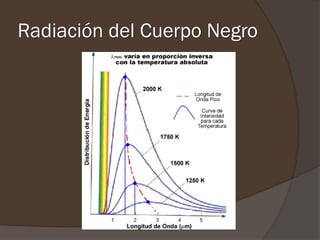
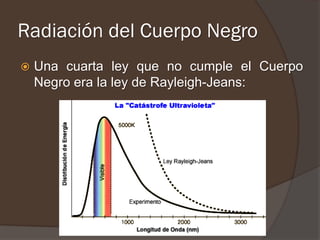
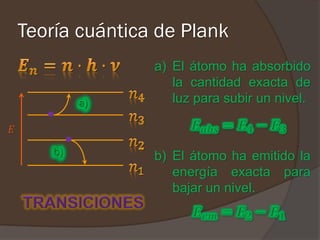
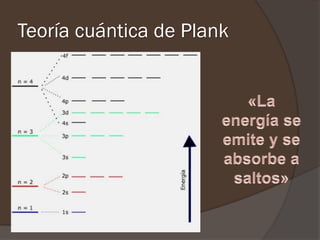
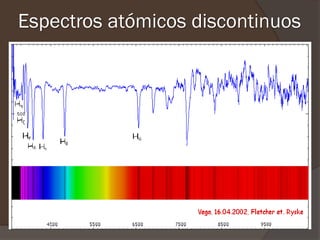
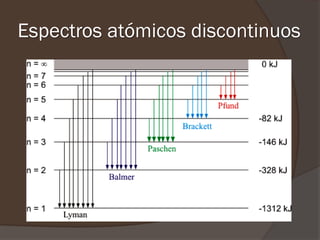
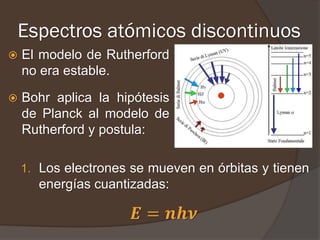
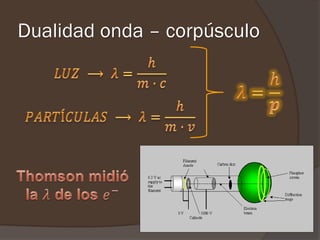
El documento describe la radiación del cuerpo negro y las leyes que lo rigen. Explica la teoría cuántica de Planck y cómo resolvió problemas con las leyes previas mediante la hipótesis de que la energía de los osciladores atómicos está cuantizada. También cubre efectos como el fotoeléctrico y cómo Einstein los explicó usando la naturaleza cuántica de la luz.