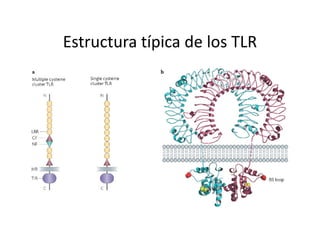
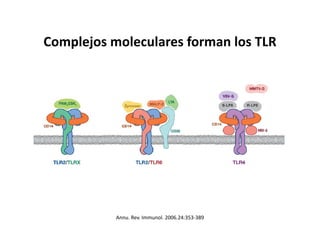
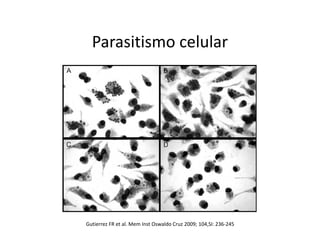
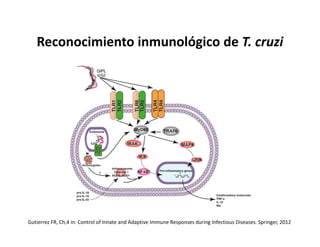
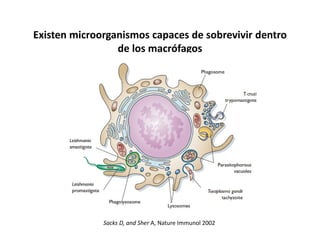
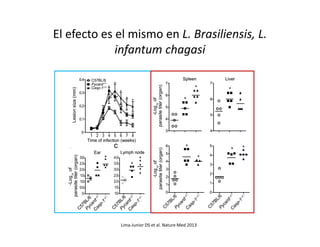
Este documento describe los diferentes tipos de receptores de la inmunidad innata, incluyendo receptores de tipo Toll (TLR) y receptores que contienen dominios ricos en leucina (NLR). Los TLR detectan patrones moleculares asociados a patógenos, mientras que los NLR detectan señales de daño celular e inducen la formación del inflamasoma. El inflamasoma activa la caspasa 1 y conduce a la maduración e secreción de citoquinas proinflamatorias como la interleucina 1 beta. La activación correcta de estos receptores