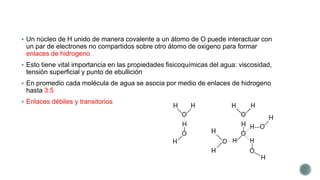
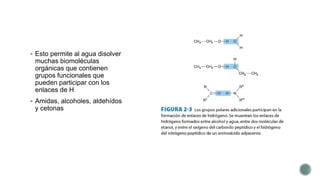
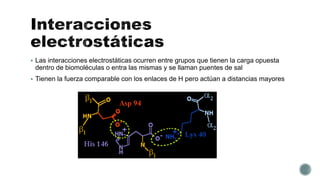
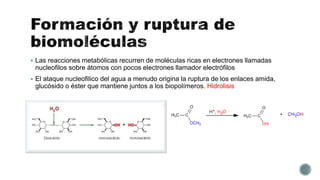
El documento describe las propiedades fundamentales del agua. El agua es el componente químico predominante de los organismos vivos y puede disolver una amplia gama de moléculas debido a su capacidad de formar enlaces de hidrógeno. El agua tiene una estructura bipolar y una constante dieléctrica alta, lo que reduce las fuerzas de atracción entre especies cargadas. Los enlaces de hidrógeno son clave para las propiedades del agua y permiten que disuelva biomoléculas orgánicas.