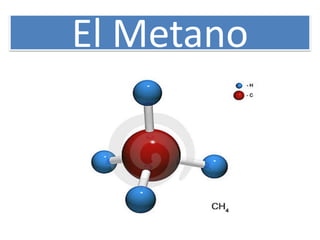
El metano (CH4) es un gas incoloro e inodoro que se produce naturalmente a través de la descomposición de materia orgánica y que contribuye significativamente al efecto invernadero. El metano puede utilizarse como combustible pero también causa problemas ambientales como el calentamiento global.