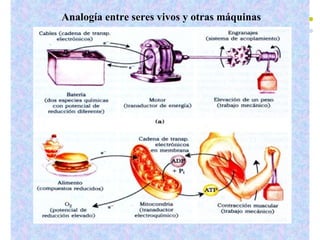
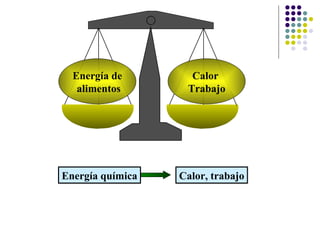
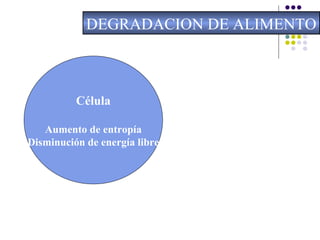
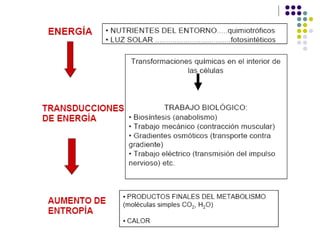
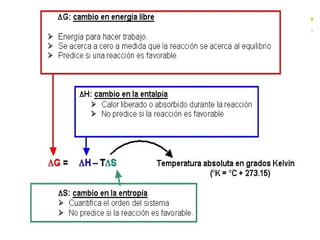
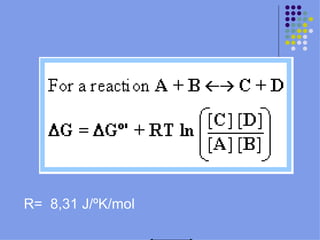
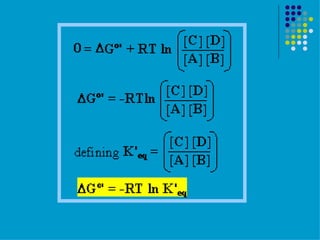
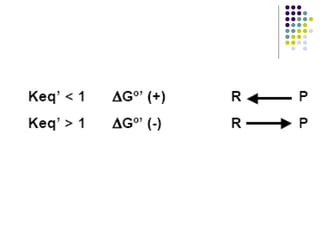
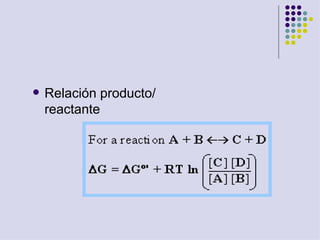
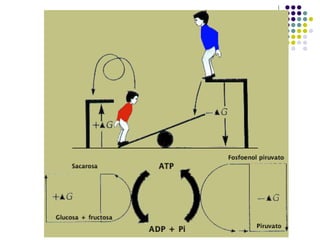
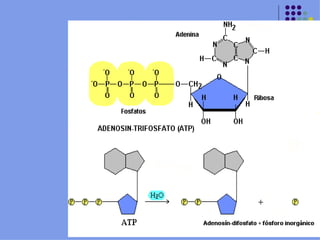
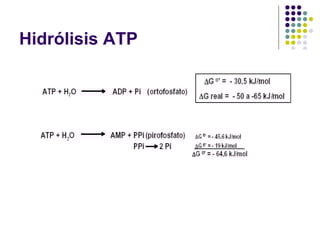
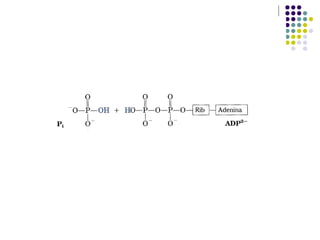
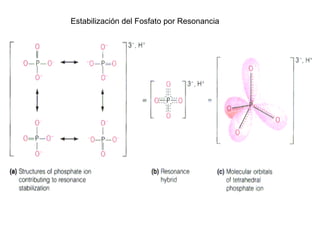
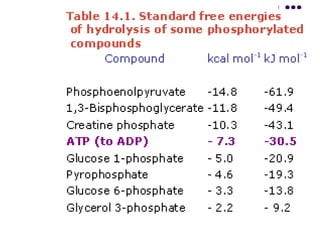
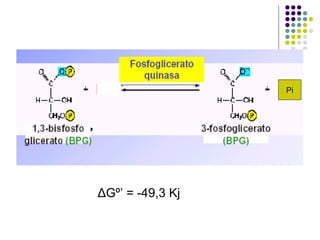
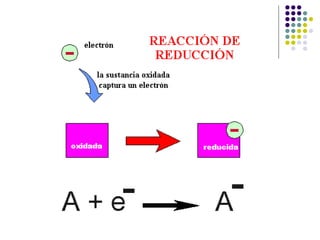
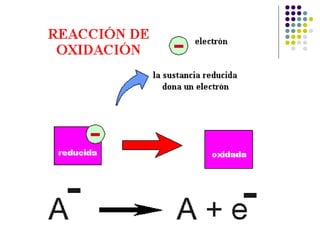
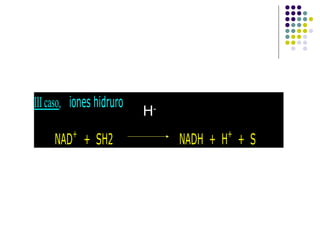
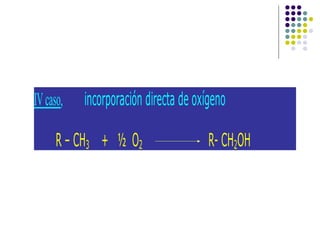
Este documento trata sobre bioenergética y cómo los seres vivos intercambian y transforman energía. Explica que la energía no se crea ni destruye, solo se transforma. Describe cómo las células utilizan reacciones acopladas para generar ATP a partir de la degradación de alimentos, permitiendo que ocurran reacciones que normalmente no serían espontáneas. Finalmente, resume que la fosforilación oxidativa y la fosforilación a nivel de sustrato son los mecanismos clave mediante los cuales las cél