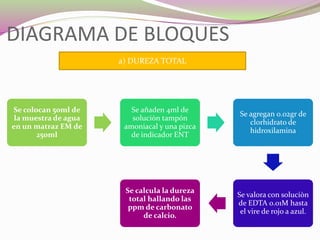
Este documento describe una práctica de laboratorio para determinar la dureza total y la concentración de calcio en muestras de agua mediante titulación con EDTA. Los estudiantes aprenden a preparar una solución estándar de EDTA, realizar las titulaciones usando eriocromo negro T como indicador, y calcular los resultados en términos de ppm de carbonato de calcio. El objetivo es evaluar la dureza del agua y la presencia de sales de calcio y magnesio.