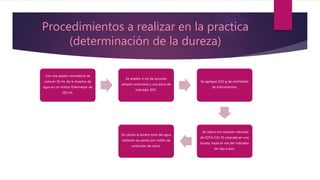
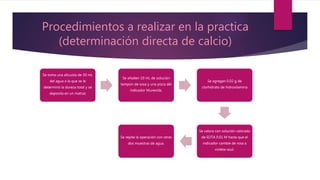
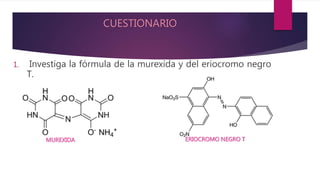
Este documento describe una práctica de laboratorio realizada por estudiantes de ingeniería química para determinar la dureza total y de calcio en muestras de agua mediante titulación con EDTA. Los estudiantes midieron la dureza usando indicadores como el negro de eriocromo T y la murexida, y calcularon los resultados en partes por millón de carbonato de calcio. Determinaron que la dureza total promedio fue de 34.2 ppm y la dureza de calcio promedio fue de 15 ppm.