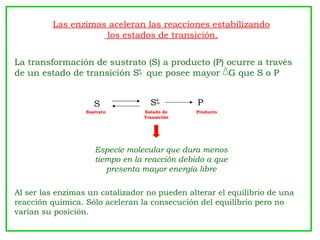
1) La cinética enzimática describe cómo las enzimas aceleran las reacciones químicas al estabilizar los estados de transición y reducir la energía de activación. 2) El modelo de Michaelis-Menten explica que la velocidad de una reacción depende de la concentración de sustrato y alcanza un máximo (Vmax) a altas concentraciones. 3) La constante de Michaelis (KM) representa la concentración de sustrato a la cual la velocidad es la mitad de Vmax.








![La primera etapa de la catálisis enzimática es la
formación del complejo [ES]
Esto ha sido demostrado, debido a que a concentraciones constantes
de enzima, la velocidad de reacción aumenta con la concentración del
sustrato, hasta alcanzar una velocidad máxima. Las reacciones no
catalizadas no muestran este efecto de saturación.
Velocidad máxima (Vmax).
A altas concentraciones de
Velocidad de reacción
sustrato, los centros
catalíticos están ocupados
por él y por lo tanto la
velocidad de la reacción
alcanza el máximo
[Sustrato]](https://image.slidesharecdn.com/clase7cineticaenzimatica-090716205617-phpapp01/85/Clase-7-Cinetica-Enzimatica-10-320.jpg)

![El modelo de Michaelis-Menten, permite conocer la velocidad a la que
se lleva a cabo una reacción mediante la siguiente ecuación:
KM es una relación de
V = Vmáx [S] constantes de velocidad
[S]KM para una determinada
reacción.
Esta ecuación quiere decir que:
- Cuando la concentración del sustrato es mucho menor que la KM, la
velocidad es directamente proporcional a la concentración de sustrato
V = [S] Vmáx
KM
- Cuando la concentración de sustrato es mucho mayor que la KM, la V=
Vmáx, la velocidad es máxima, independiente de la concentración de
sustrato](https://image.slidesharecdn.com/clase7cineticaenzimatica-090716205617-phpapp01/85/Clase-7-Cinetica-Enzimatica-12-320.jpg)
![Cuando:
[S]=KM entonces V= Vmáx
2
Así, KM es aquella concentración de sustrato a la cual la velocidad de la
reacción se hace la mitad de su valor máximo.](https://image.slidesharecdn.com/clase7cineticaenzimatica-090716205617-phpapp01/85/Clase-7-Cinetica-Enzimatica-13-320.jpg)
![Variando la concentración de sustrato se pueden
medir Vmáx y KM
La ecuación de Michaelis-Menten puede transformarse en otra que
representa gráficamente resulta en una línea recta. Esto se consigue
tomando los valores inversos de los miembros de la ecuación.
1 1 + KM X 1
=
V Vmáx Vmáx [S]
Esta ecuación puede ser graficada mediante la representación de
Lineweaver-Burk](https://image.slidesharecdn.com/clase7cineticaenzimatica-090716205617-phpapp01/85/Clase-7-Cinetica-Enzimatica-14-320.jpg)



