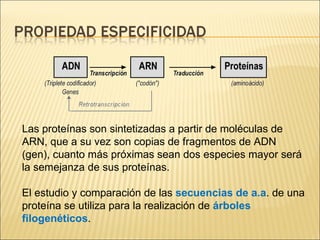
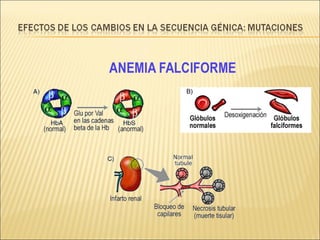
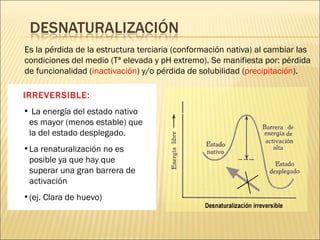
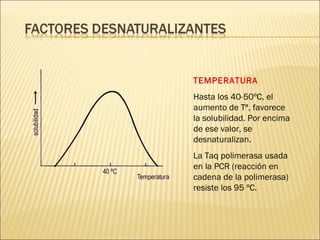
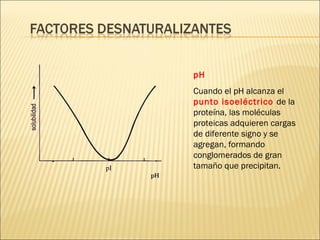
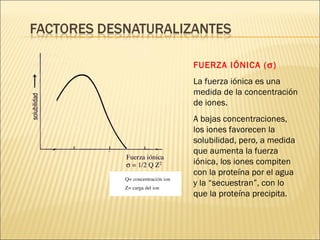
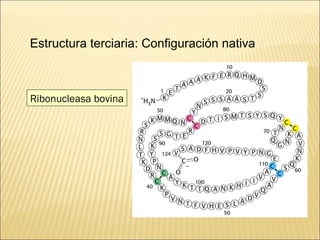
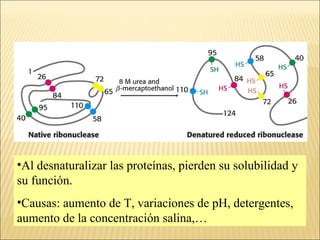
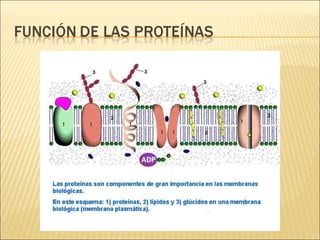
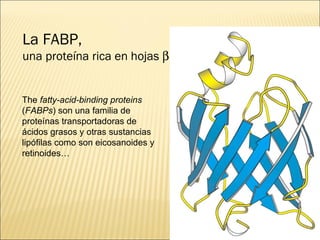
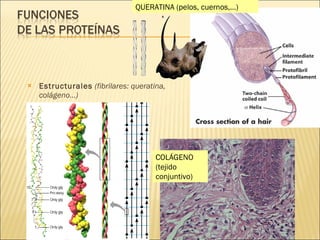
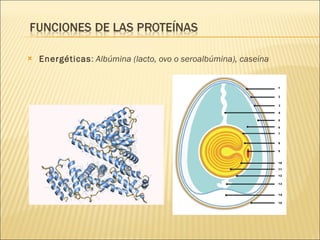
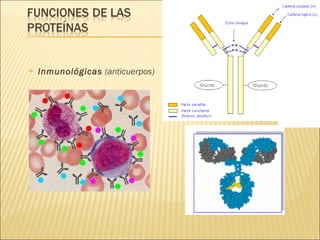
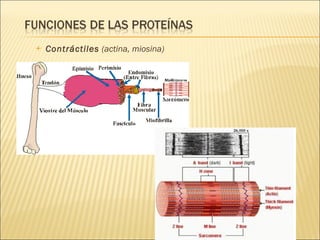
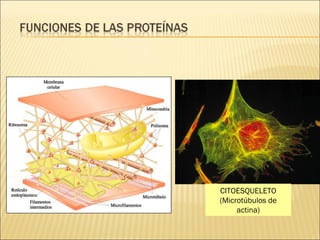
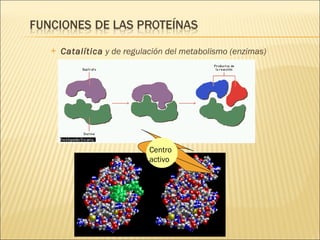
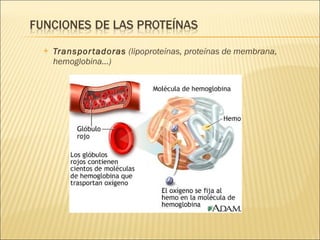
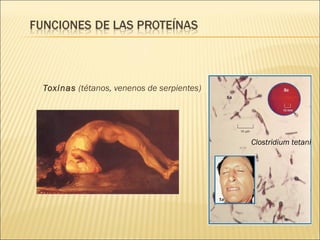
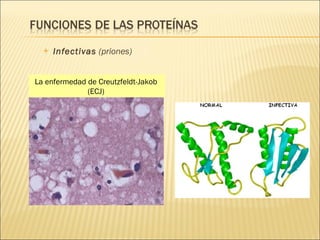
El documento aborda las propiedades, funciones y clasificación de las proteínas, destacando su solubilidad y desnaturalización, así como su especificidad funcional y de especie. Se menciona que las proteínas son esenciales para diversas funciones biológicas y su estructura puede verse afectada por factores como la temperatura y el pH. También se discuten ejemplos específicos de proteínas y su relevancia en procesos biológicos y enfermedades.