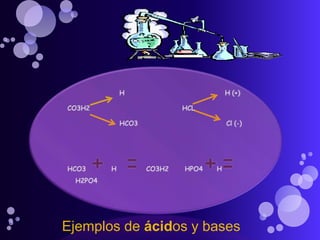
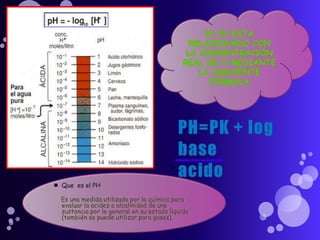
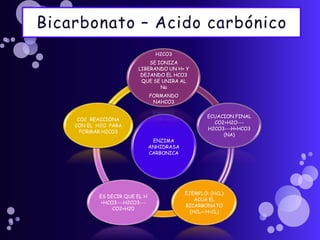
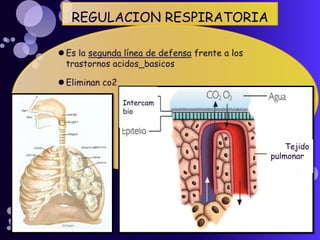
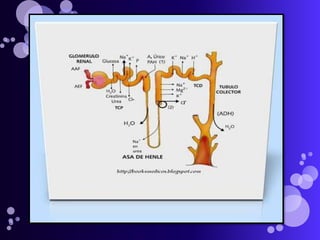
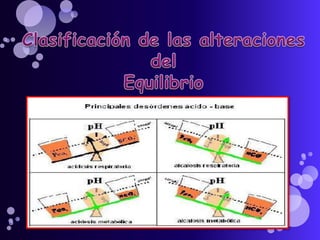
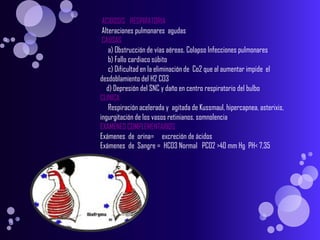
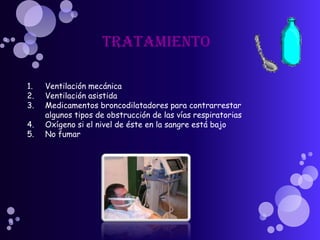
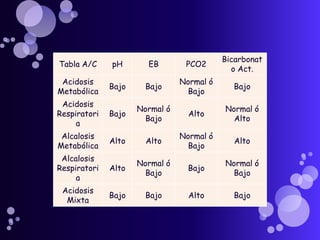
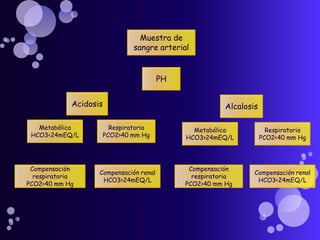
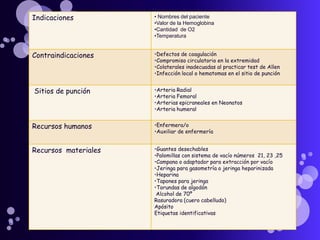
Este documento proporciona información sobre el equilibrio ácido-base en el cuerpo. Explica conceptos clave como pH, ácidos, bases y buffers. Describe las tres líneas de defensa del organismo para mantener el equilibrio ácido-base: regulación respiratoria, regulación renal y sistemas tampón. También clasifica y explica las causas y tratamientos de diferentes tipos de alteraciones como acidosis metabólica, acidosis respiratoria y alcalosis. El documento concluye con detalles sobre la gasometría arterial y sus us