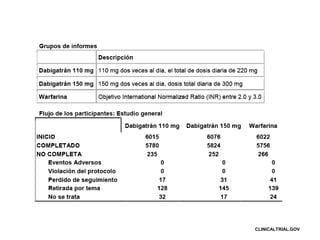
Este documento presenta un resumen de los métodos utilizados en el estudio experimental "Evaluación al azar de la terapia anticoagulante a largo plazo (RE-LY)". El estudio comparó dos dosis fijas de dabigatrán con warfarina en pacientes con fibrilación auricular, midiendo los resultados de accidente cerebrovascular. El estudio fue aleatorizado, doble ciego y multicéntrico, y fue aprobado por comités de ética. Los resultados mostraron que dabigatrán fue más efectivo que warfarina