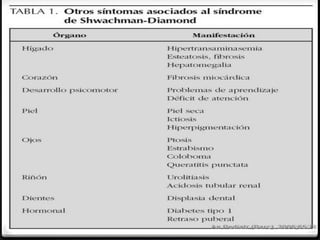
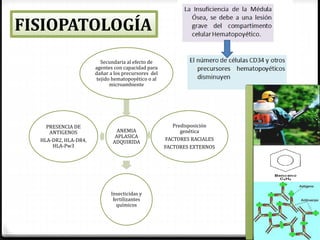
1. La aplasia medular adquirida es una enfermedad que causa una disminución de las células sanguíneas debido al daño del tejido hematopoyético en la médula ósea, lo que lleva a pancitopenia. 2. Puede ser causada por fármacos, radiaciones, virus u otras enfermedades y suele tratarse con transfusiones de sangre, antibióticos y trasplante de médula ósea. 3. La inmunosupresión con anticuerpos antitimocíticos y cic