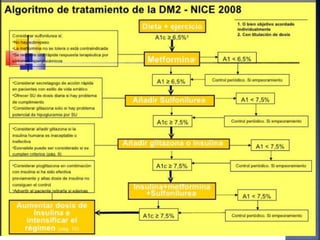
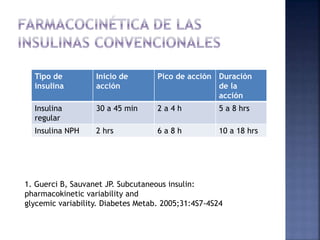
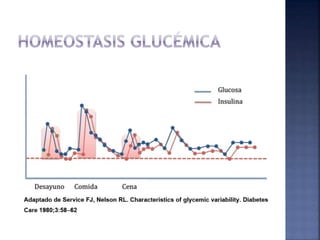
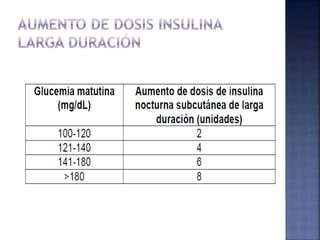
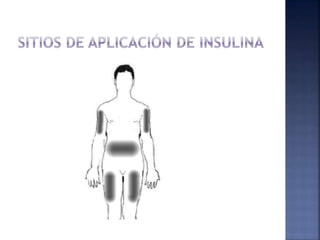
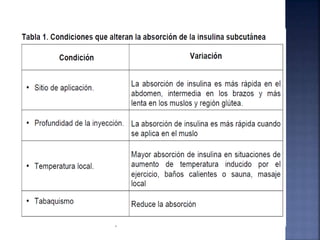
El documento resume la historia y tipos de insulina. Banting y Best aislaron la insulina por primera vez en 1921 y la primera inyección de insulina fue en 1922. Existen insulinas convencionales, análogos de insulina y premezcladas. Las insulinas se clasifican por su inicio, pico y duración de acción.