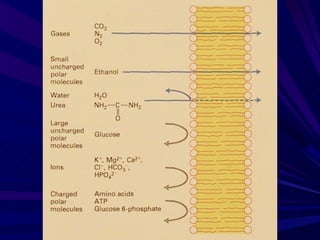
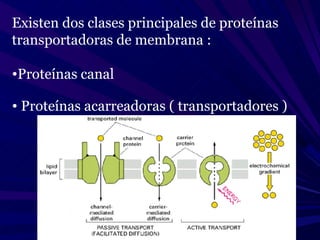
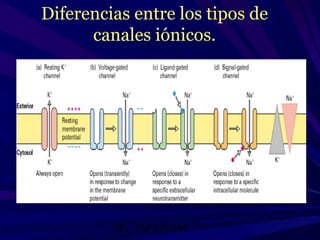
El documento describe cómo los fármacos modifican la actividad de diferentes tipos de moléculas como moléculas transportadoras, receptores, enzimas y proteínas. Explica los diferentes tipos de receptores como receptores canal, acoplados a proteínas G, con actividad de cinasa y que regulan la transcripción génica, y cómo cada tipo tiene una localización, efecto y mecanismo de acoplamiento distinto.