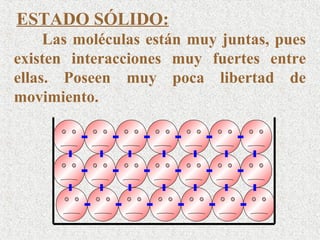
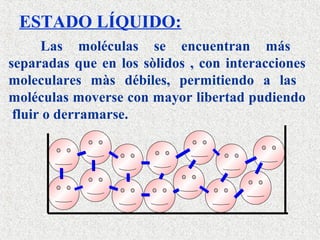
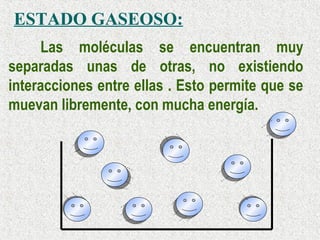
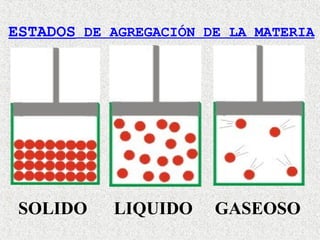
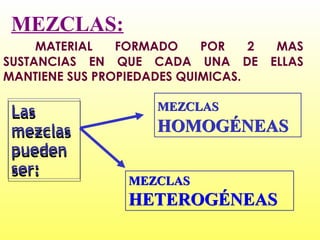
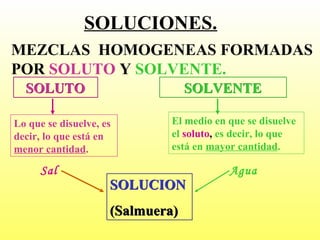
Este documento clasifica la materia según su estado de agregación (sólido, líquido y gaseoso) y composición (sustancias puras y mezclas). Las sustancias puras están formadas por un solo elemento o compuesto, mientras que las mezclas contienen dos o más sustancias que mantienen sus propiedades individuales. Las mezclas pueden ser homogéneas o heterogéneas.