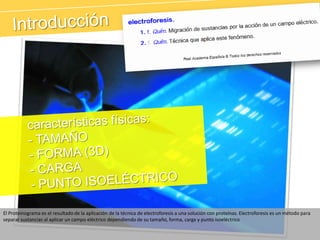
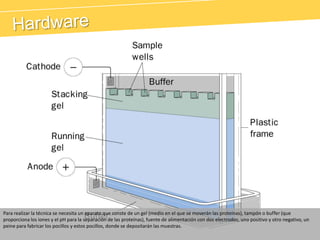
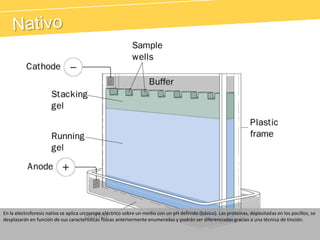
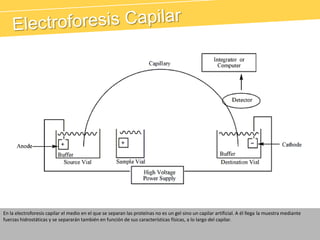
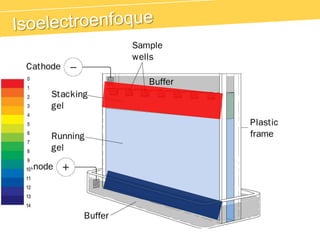
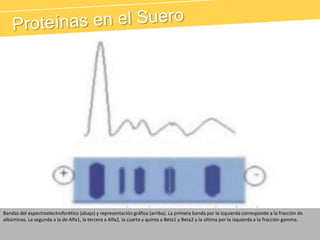
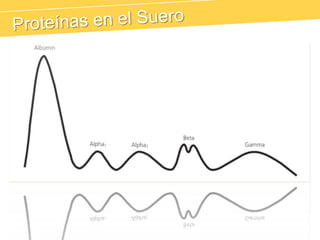
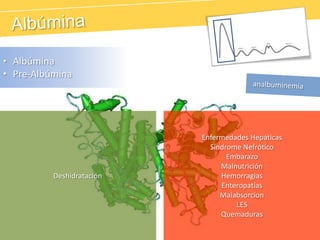
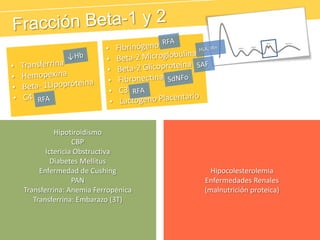
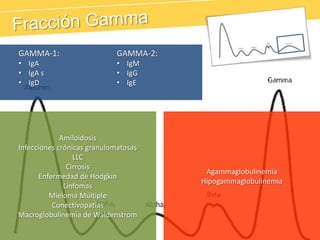
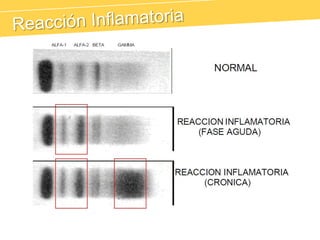
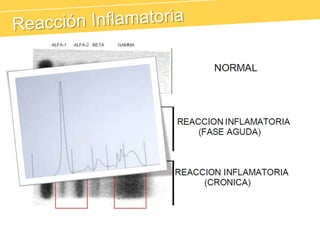
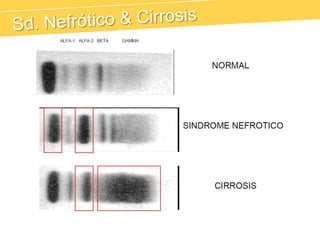
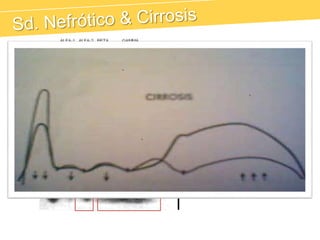
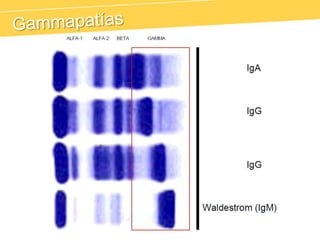
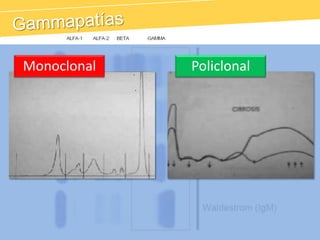
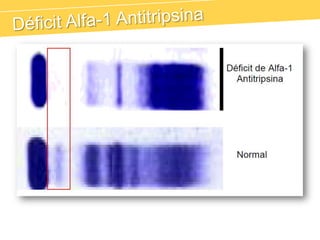
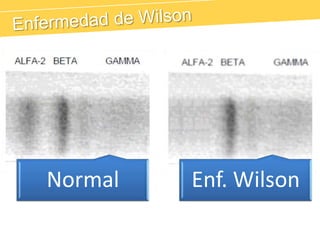
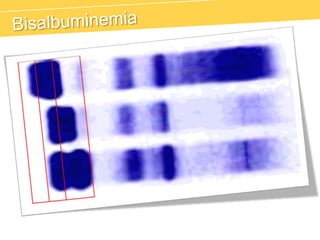
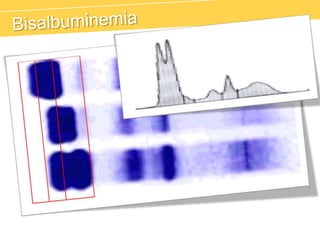
El documento describe el proteinograma, que es el resultado de la electroforesis de proteínas en función de sus características físicas como tamaño y carga. Se explican diversos métodos de electroforesis, incluyendo nativa, SDS-PAGE e isoelectroenfoque, y su aplicación en la separación y análisis de proteínas en suero. Además, se detallan las fracciones de proteínas y sus implicaciones clínicas en diferentes condiciones de salud.