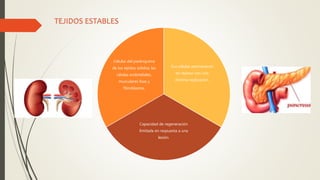
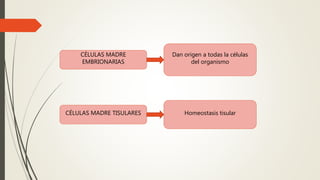
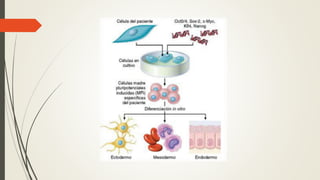
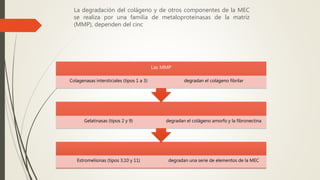
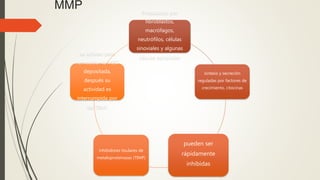
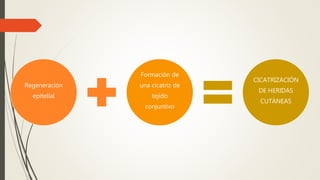
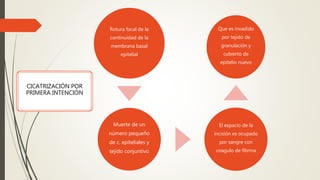
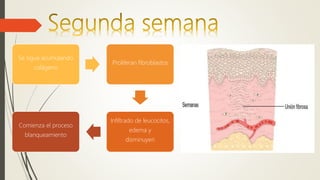
La reparación tisular es esencial para la supervivencia y depende de la regeneración celular y la formación de cicatriz. Existen dos tipos de reacciones de reparación: la regeneración, que implica la proliferación de células residuales, y la formación de cicatriz, que implica el depósito de tejido conjuntivo. La capacidad de reparación depende del tipo de tejido lesionado y de la presencia de células madre.