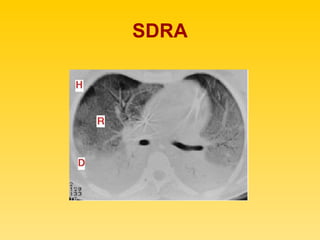
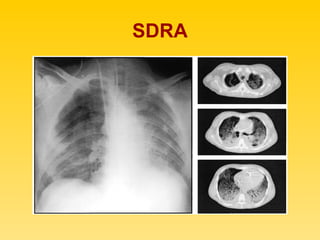
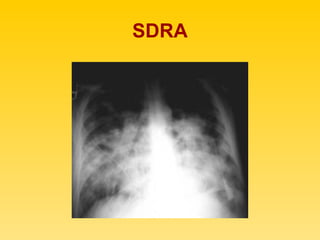
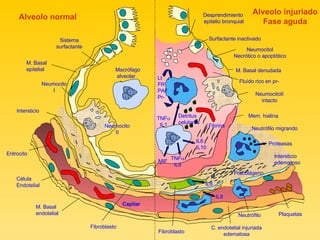
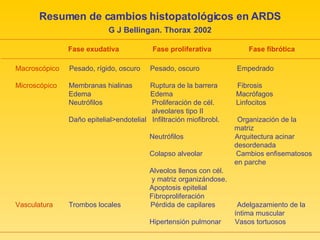
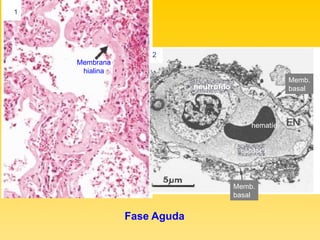
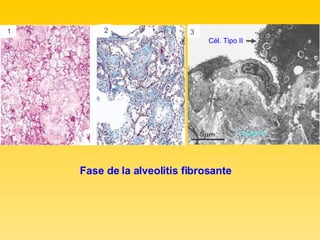
El documento describe el síndrome de distress respiratorio agudo (SDRA), indicando que se caracteriza por daño alveolar difuso y alta mortalidad. Explica que es una lesión pulmonar difusa asociada con edema no cardíaco que causa insuficiencia respiratoria grave e hipoxemia. Detalla los mecanismos fisiopatológicos involucrados y las fases aguda, proliferativa y fibrótica por las que atraviesa.









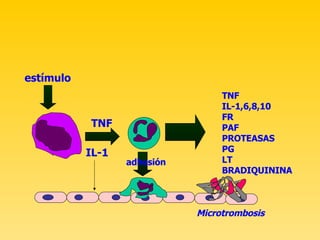


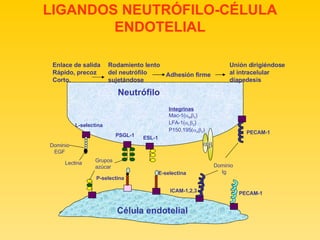





![ECUACION DE STARLING Qf: Kf (Pcap-Pi) - o (Cocap-Copi)] Aumento de la permeabilidad capilar a las proteínas por alteración en la función de la barrera alveolo capilar Edema alveolar con alto contenido proteico](https://image.slidesharecdn.com/sdra-1200783380693795-2/85/SDRA-24-320.jpg)