Aspectos derivados de la mecánica cuántica importantes para el curso de química analítica 3
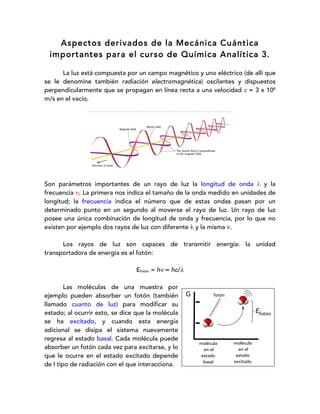
- 1. Aspectos derivados de la Mecánica Cuántica importantes para el curso de Química Analítica 3. La luz está compuesta por un campo magnético y uno eléctrico (de allí que se le denomine también radiación electromagnética) oscilantes y dispuestos perpendicularmente que se propagan en línea recta a una velocidad c = 3 x 108 m/s en el vacío. Son parámetros importantes de un rayo de luz la longitud de onda λ y la frecuencia ν. La primera nos indica el tamaño de la onda medido en unidades de longitud; la frecuencia indica el número que de estas ondas pasan por un determinado punto en un segundo al moverse el rayo de luz. Un rayo de luz posee una única combinación de longitud de onda y frecuencia, por lo que no existen por ejemplo dos rayos de luz con diferente λ y la misma ν. Los rayos de luz son capaces de transmitir energía: la unidad transportadora de energía es el fotón: Efotón = hν = hc/λ Las moléculas de una muestra por ejemplo pueden absorber un fotón (también llamado cuanto de luz) para modificar su estado; al ocurrir esto, se dice que la molécula se ha excitado, y cuando esta energía adicional se disipa el sistema nuevamente regresa al estado basal. Cada molécula puede absorber un fotón cada vez para excitarse, y lo que le ocurre en el estado excitado depende de l tipo de radiación con el que interacciona. G fotón Efotón molécula en el estado basal molécula en el estado excitado
- 2. Los fotones de la radiación ultravioleta cercano (200 – 400 nanómetros) y de la luz visible (400 a 750 nm) efectúan un fenómeno denominado transición electrónica, que ocasiona que los electrones de mayor contenido energético de una molécula cambien la manera en la que circulan. Esto involucra que los electrones que se encuentran en un determinado orbital molecular pasen a circular en otro de mayor energía que se encuentre vacío. Un orbital molecular es un espacio en el que circulan los electrones en una molécula. Dichos orbitales son análogos a los orbitales atómicos (1s, 2s, 2p, 3s, etc.) y se generan a partir de argumentos basados en la Mecánica Cuántica mezclando los orbitales de los átomos que constituyen la molécula. Por ejemplo, en el caso de la molécula de hidrógeno, H2, sus orbitales moleculares se constituyen al combinar los orbitales 1s de cada átomo de hidrógeno formándose dos nuevos orbitales moleculares; al de menor energía se le denomina σ (o de enlace) y al de mayor energía σ* (de antienlace). Los orbitales moleculares pueden ser π (pi de enlace), π* (pi de antienlace) o n (no enlazantes). Como dato adicional, los electrones en un orbital de enlace se encargan de mantener unidos a los átomos y, por tanto, refuerzan la estabilidad de la molécula; en un orbital de antienlace, por el contrario, los electrones se encargan de destruir a la molécula, y en uno de no enlace los electrones ni estabiulizan ni desestabilizan a la molécula. Vale mencionar que en las moléculas en realidad los orbitales de enlace por regla general siempre están llenos, mientras que los de antienlace se encuentran despoblados de electrones. Los orbitales moleculares se representan en diagramas donde a cada uno de ellos le corresponde una línea al lado de su nombre: entre más arriba se encuentre, mayor contenido energético posee. No todos los orbitales moleculares de una molécula son de interés para el químico: por ejemplo, en el Orbital de enlace Orbital de antienlace
- 3. caso del benceno, de la multitud que posee, sólo nos interesan seis: los tres de enlace que poseen el mayor contenido energético (π1, π2 y π3) y los tres de antienlace que poseen el menor contenido energético (π∗4, π∗5 y π∗6). Los tres primeros se hallan ocupados y los siguientes tres se hayan vacíos (no poseen electrones) si consideramos la molécula de benceno en su estado basal. El diagrama correspondiente es el siguiente. Advierte que algunos orbitales moleculares aparecen a la misma altura: π2 y π3 por ejemplo. Ello indica que poseen el mismo contenido energético. tampoco aparecen los asteriscos asociados a los orbitales de alntienlace. ¿Cómo aprovechar la información que nos da este diagrama? Suponte que la molécula de benceno recibe luz cuyos fotones poseen un contenido energético exactamente de la misma magnitud que la diferencia de energía que hay entre el nivel energético que poseen los orbitales π2 y π3 y el que poseen los π4 y π5. Entonces puede ocurrir una transición, que los químicos representan de manera simplificada así: o, más formalmente, así: fotón
- 4. π1(2) π2(2) π3(2) π∗4(0) π∗4(0) π∗4(0) → π1(2) π2(2) π3(0) π∗4(2) π∗4(0) π∗4(0) o bien una segunda posibilidad, indistinguible de la anterior (y de hecho, habría otras dos más…¿cuáles?): π1(2) π2(2) π3(2) π∗4(0) π∗4(0) π∗4(0) → π1(2) π2(2) π3(0) π∗4(0) π∗4(2) π∗4(0) Esta absorción se puede registrar en un espectrofotómetro de UV-visible como un máximo de absorción. Lo anterior quiere decir que al absorber un fotón, dos electrones que se ubican en el nivel de ocupación electrónica con el mayor contenido energético la molécula de benceno pasan transitoriamente a circular al nivel con desocupación electrónica de menor contenido energético.
