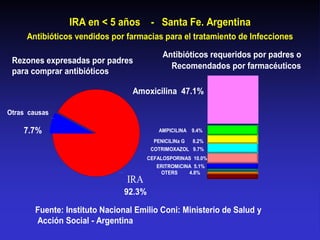
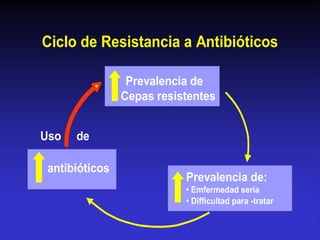
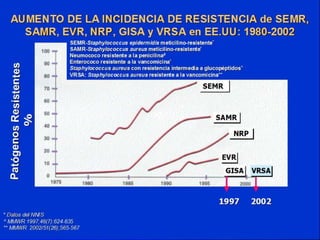
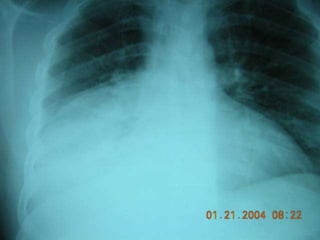
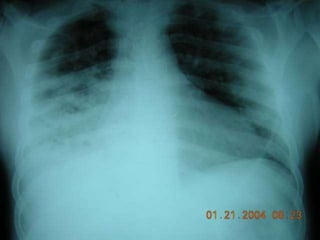
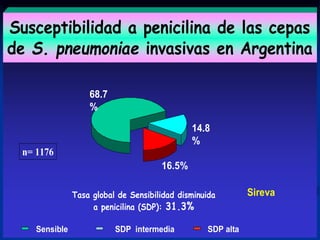
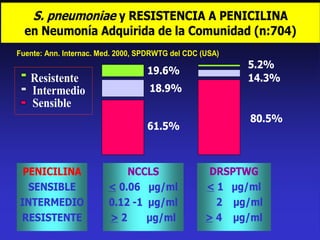
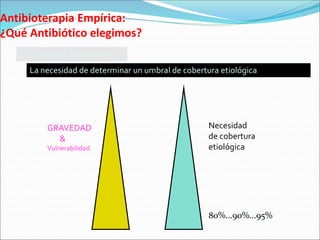
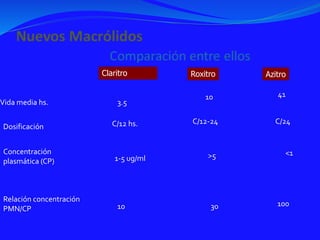
Este documento presenta datos sobre el uso de antibióticos para el tratamiento de infecciones respiratorias agudas (IRA) en niños menores de 5 años en Santa Fe, Argentina. Muestra que el 92.3% de los casos son IRA y que el antibiótico más recetado es la amoxicilina (47.1%), seguido por cotrimoxazol (9.7%) y cefalosporinas (10%). También analiza cambios en los patógenos que causan infecciones severas en pacientes hospitalizados y la resistencia creciente a antibióticos.
















































































![:
Diagn Microbiol Infect Dis. 2008 Jul;61(3):329-
38. Epub 2008 May 27.
Integrated results of 2 phase 3 studies comparing tigecycline and levofloxacin in community-
acquired pneumonia.
Tanaseanu C., Bergallo C., Teglia O., Jasovich A., Oliva M.E., Dukart G., Dartois N., Cooper C.A.,
Gandjini H., Mallick R.,
Department of Internal Medicine, St. Pantelimon Clinical Emergency Hospital, Bucharest OP 22, Romania. cristina.tanaseanu@gmail.com
Tigecycline (TGC), a glycylcycline, has expanded activity against Gram-positive and Gram-negative, anaerobic, and atypical bacteria. Two phase 3
studies were conducted. Hospitalized patients with community-acquired pneumonia (CAP) were randomized to intravenous (IV) TGC (100 mg
followed by 50 mg bid) or IV levofloxacin (LEV) (500 mg bid). In 1 study, patients could be switched to oral LEV after at least 3 days intravenously.
The coprimary efficacy end points were as follows: clinical response in clinically evaluable (CE) and clinical modified intent-to-treat (c-mITT)
populations at test-of-cure (TOC). The secondary end points were as follows: microbiologic efficacy and susceptibility to TGC for CAP bacteria. Safety
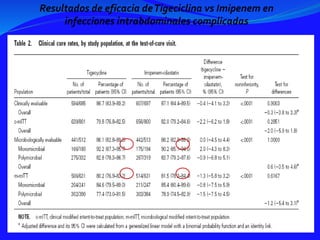
evaluations were included. Eight hundred ninety-one were patients screened: 846 mITT (TGC 424, LEV 422), 574 CE (TGC 282, LEV 292). Most
patients had Fine Pneumonia Severity Index II to IV (80.7% TGC, 74.4% LEV, mITT). At TOC (CE), TGC cured 253/282 patients (89.7%) and LEV
cured 252/292 patients (86.3%); the absolute difference of TGC-LEV was 3.4% (95% confidence interval [CI], -2.2 to 9.1, noninferior [P < 0.001]). In c-
mITT, TGC cured 319/394 patients (81.0%) and LEV cured 321/403 patients (79.7%); the absolute difference of TGC-LEV was 1.3% (95% CI -4.5 to 7.1,
noninferior [P < 0.001]). The drug-related adverse events (AEs) of nausea (20.8% TGC versus 6.6% LEV) and vomiting (13.2% TGC versus 3.3% LEV)
were significantly higher in TGC; elevated alanine aminotransferase (2.8% TGC versus 7.3% LEV) and aspartate aminotransferase (2.6% TGC versus
6.9% LEV) were significantly higher in LEV. Discontinuations for AEs were low (TGC, 26 patients [6.1%]; LEV, 34 patients [8.1%]). TGC appeared safe
and achieved cure rates similar to LEV in hospitalized patients with CAP.](https://image.slidesharecdn.com/atb-200311225136/85/Antibioticos-98-320.jpg)