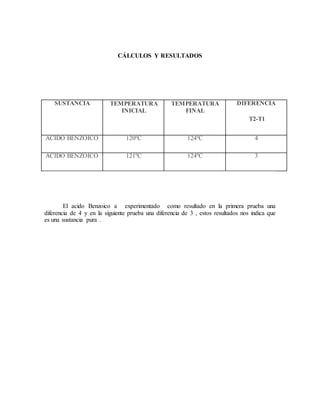
Este documento presenta los detalles de un experimento de laboratorio para determinar el punto de fusión del ácido benzoico. El objetivo era medir la temperatura a la que el ácido benzoico cambia de estado sólido a líquido. Los estudiantes pulverizaron el ácido benzoico, lo colocaron en un capilar y lo calentaron en un baño de aceite mientras monitoreaban la temperatura. Determinaron que el punto de fusión del ácido benzoico es de aproximadamente 124°C, lo que indica que es una sustancia pura.