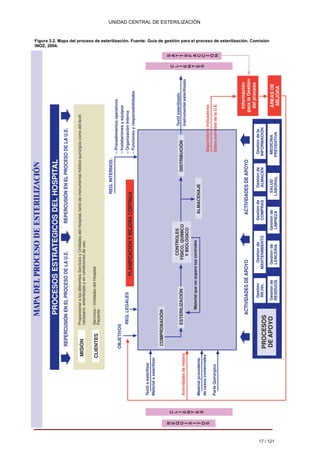
1. La unidad central de esterilización (UCE) recibe, procesa, almacena y distribuye material e instrumental quirúrgico estéril para su uso clínico en áreas definidas.
2. Los objetivos de la UCE son garantizar la esterilización cumpliendo estándares de calidad, seguridad y eficiencia, así como controlar el proceso y proteger la salud de trabajadores y pacientes.
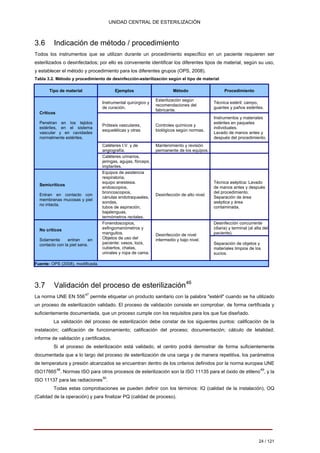
3. El documento presenta recomendaciones pero no establece requisitos normativos para la autorización o acredit
















































































































![Al007
UNIDAD CENTRAL DE ESTERILIZACIÓN
58 UNE-EN ISO 11607-1:2009. Envasado para productos sanitarios esterilizados terminalmente. Parte 1:
Requisitos para los materiales, los sistemas de barrera estéril y sistemas de envasado (ISO 11607-1:2006) y
más partes, relativas a los sistemas de envasado. Consultado el 30.03.2010 en: http://normasune.blogspot.com.
59 Muro I., Criado JJ. Capítulo 6. Estructura de la central de esterilización: organización y dinámica del trabajo
de la central de esterilización. En: Criado Álvarez JJ, Peláez Ros B y Fereres Castiel J. (Coord.). Esterilización
en Centros Sanitarios. Fundación para la Investigación sanitaria en Castilla-La Mancha, 2008, pp: 91-104.
60 Zanón Viguer, VC. Riesgos específicos y su prevención en el sector sanitario. Cap.12 En Manual de
formación para delegados de prevención de sector sanitario [Monografía]. Valencia Consellería de Sanitat.
2001. ISBN 84-482-2921-5.García Escutia, María Concepción; Tormo Pérez, Eduardo.
61 Condiciones de uso y riesgos profesionales en la utilización de óxido de etileno en proceso de esterilización
en hospitales. INST. Ministerio de Trabajo y Seguridad Social. 1990.
62 Gené N. Cap. 2. Esterilización por calor. En: Criado JJ, Peláez B, Fereres J. (coord.). Esterilización en
centros sanitarios. Madrid: FISCAM. 2008, pp. 13-29.
63 Sánchez E, Peláez B. Cap. 5. Limpieza y desinfección de la central de esterilización. Higiene del personal.
En: Criado JJ, Peláez B, Fereres J. (coord.). Esterilización en centros sanitarios. Madrid: FISCAM. 2008, pp.
187-194.
64 National Patient Safety Agency. The national specifications for cleanliness in the NHS: a framework for
setting and measuring performance outcomes. April, 2007.
65 Sterilization. Part 2: Design considerations. Health Technical Memorandum 2010. NHS Estates (1995).
66 Sterilization. Part 3 (Including Amendement 1): Validation and verification. Health Technical Memorandum
2010. NHS Estates (1994).
67 Sterilization. Part 4: Operational management / Part 6: Testing and validation protocols. Health Technical
Memorandum 2010. NHS Estates (1997).
68 Ethylene oxide sterilization section. Health Building Note 13. Supplement 1. Health Technical Memorandum
2010. NHS Estates (1994).
69 Uribe Llopis P. Formaldehído. Uso en un centro hospitalario. Riesgos y medidas de prevención. Medicina y
Seguridad del Trabajo, 2001; 188: 43-59.
70 Sallés M, Codina C. Higiene y antisepsia del paciente. Limpieza, desinfección y esterilización en el ámbito
hospitalario. Sociedad Catalana de Farmacia Clínica.
http://www.academia.cat/societats/farmcl/llibre/higiene/643.pdf
71 Peláez B, Andrade R, Barreales L, Bomboi T, Fernández R, Fereres J. Study of environmental levels of
formaldehyde emitted by a Low Temperature Steam and Formaldehyde (LTSF) sterilizer in the Hospital Clínico
San Carlos. Zentr Steril, 2007; 15: 329-40.
72 Uribe Llopis P. Formaldehído. Uso en un centro hospitalario. Riesgos y medidas de prevención. Medicina y
Seguridad del Trabajo, 2001; 188: 43-59.
73 Díaz Padrón H, Linares Fernández TM, González Chamorro RM. Determinación de las concentraciones de
formaldehído en el aire de una central de esterilización. Rev. Cubana de Medicina del Trabajo, 2005; 6: 4-6.
74 Hidalgo Rodríguez R, González Fernández C y Chiroles Despaigne S. Análisis cuantitativo y efecto de
residuos en procesos esterilización química a bajas temperaturas. Rev. Cubana Invest. Biomed., 2006; 25.
75 Mecke P y Hagan T. Esterilización de material termosensible por vapor a baja temperatura y formaldehído.
El Autoclave, 2001; 1: 24-7.
76 Peláez B, Redondo I, Kayali N, Gaspar MC, Polo JM y Fereres J. Detection of formaldehyde residues in
plastic material sterilised in low temperature steam and formaldehyde. Zentr Steril, 2003; 11: 393-400.
119 / 121
Volver](https://image.slidesharecdn.com/centraldeesterilizacion-141102094106-conversion-gate02/85/Central-de-esterilizacion-125-320.jpg)
