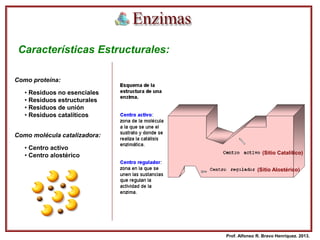
Este documento presenta información sobre las enzimas. Sus objetivos son conocer la naturaleza de las enzimas, su nomenclatura, su mecanismo de acción y los factores que afectan su actividad. Explica que las enzimas son proteínas que catalizan reacciones químicas y describe sus características, clasificación, cinética enzimática y cómo factores como la concentración de sustrato, pH y temperatura influyen en su actividad.























![Cinética Enzimática:
A B
Reacción química
Reactante Producto
v= k+1[A]
La Cinética Enzimática estudia las velocidades de las reacciones catalizadas por
enzimas y su variación frente a cambios de parámetros experimentales.
La velocidad de una reacción química corresponde al número de moléculas de
reactante (s) que se convierten en producto (s) por unidad de tiempo y depende de
la concentración de los compuestos incluídos en el proceso y de la constante de
velocidad (k) que es una característica de la reacción.
Matemáticamente esta velocidad se expresa:
Prof. Alfonso R. Bravo Henríquez. 2013.](https://image.slidesharecdn.com/enzimas2013-151019113143-lva1-app6891/85/Enzimas-25-320.jpg)
![Cinética Enzimática:
Matemáticamente esta velocidad se expresa:
La velocidad (Vo) de una reacción enzimática se puede medir por la variación de la
cantidad de sustrato transformado, o la cantidad de producto formado por unidad
de tiempo.
Las reacciones catalizadas por enzimas tienen cinética de saturación:
Cuando se miden las velocidades iniciales (Vo) de una reacción enzimática con
distintas concentraciones de sustrato [S] en las mismas condiciones de pH y
temperatura y manteniendo constante la concentración de enzima [E], se obtiene
una curva como se representa a continuación:
Vmáx [S]
Km + [S]Vo =
Enzimas
Es la ecuación de Michaelis-Menten.
Leonor Micahelis (1875-1949) y Maud Menten (1879-1960)
Prof. Alfonso R. Bravo Henríquez. 2013.](https://image.slidesharecdn.com/enzimas2013-151019113143-lva1-app6891/85/Enzimas-26-320.jpg)
![Cinética Enzimática:
Cinética de Saturación:
La reacción en presencia de mayor [S] no produce mayor velocidad porque todas
las moléculas de enzima están saturadas con sustrato. La enzima alcanza la
velocidad máxima (Vmax).
La ecuación de Michaelis-Menten es una
hipérbola rectangular.
Velocidaddelareacción
Concentración de sustrato
Km es la constante de Michaelis.
En condiciones definidas de pH y
temperatura, los valores de Km y Vmáx son
las constantes cinéticas de una determinada
enzima frente a su sustrato.
La ecuación de Michaelis-Menten puede ser usada para
demostrar que la concentración de sustrato necesaria para
alcanzar la mitad de Vmáx, es numéricamente igual a Km.
Prof. Alfonso R. Bravo Henríquez. 2013.](https://image.slidesharecdn.com/enzimas2013-151019113143-lva1-app6891/85/Enzimas-27-320.jpg)






















