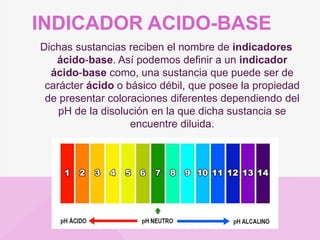
El documento presenta información sobre el pH, pOH, ácidos y bases. Define el pH como una medida de acidez o alcalinidad y el pOH como el logaritmo negativo de la concentración de iones hidroxilo. Explica que los ácidos producen soluciones con pH menor que 7 mientras que las bases producen iones al disolverse. También diferencia entre ácidos y bases fuertes y débiles dependiendo de su grado de disociación en agua.