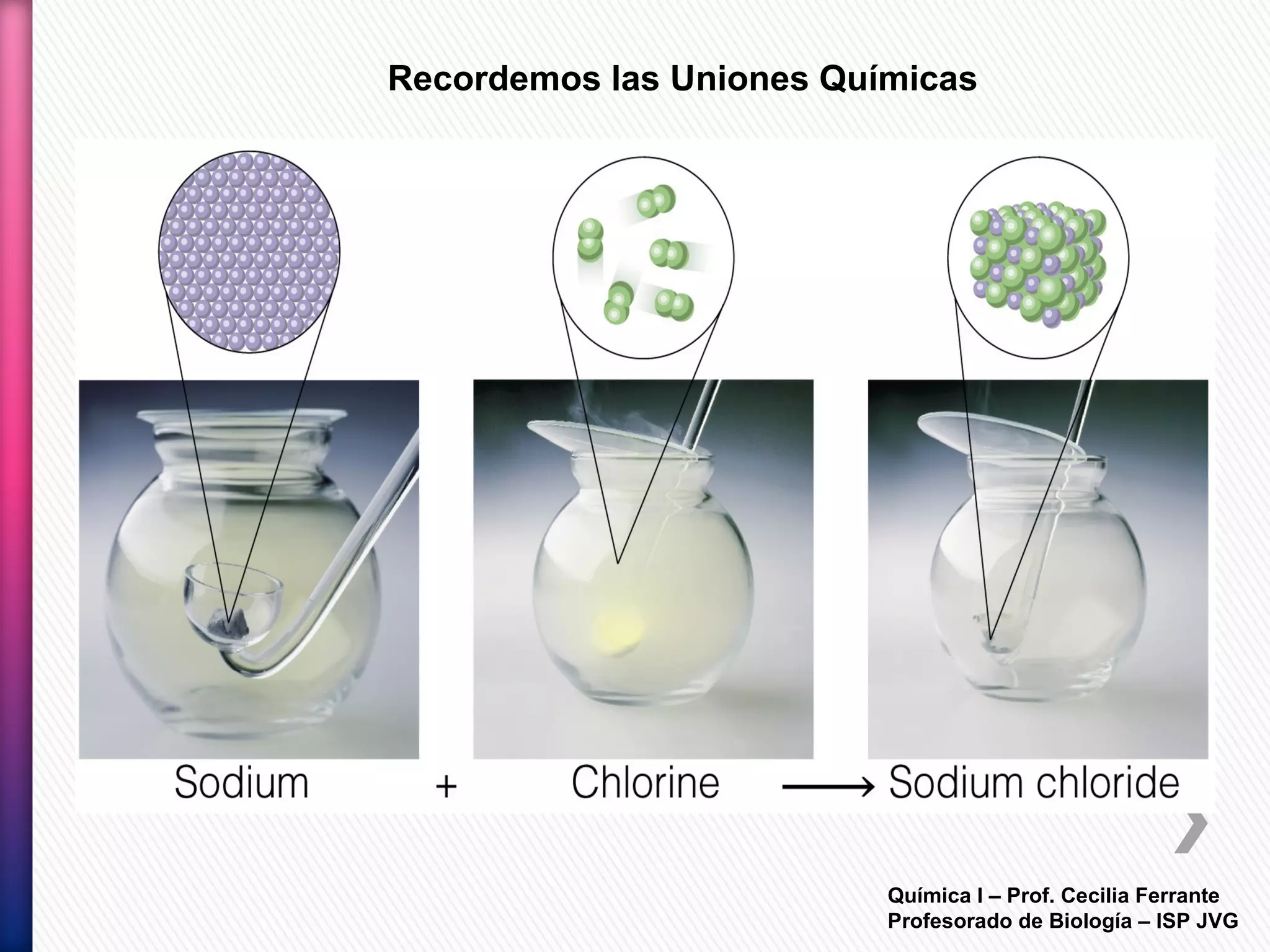
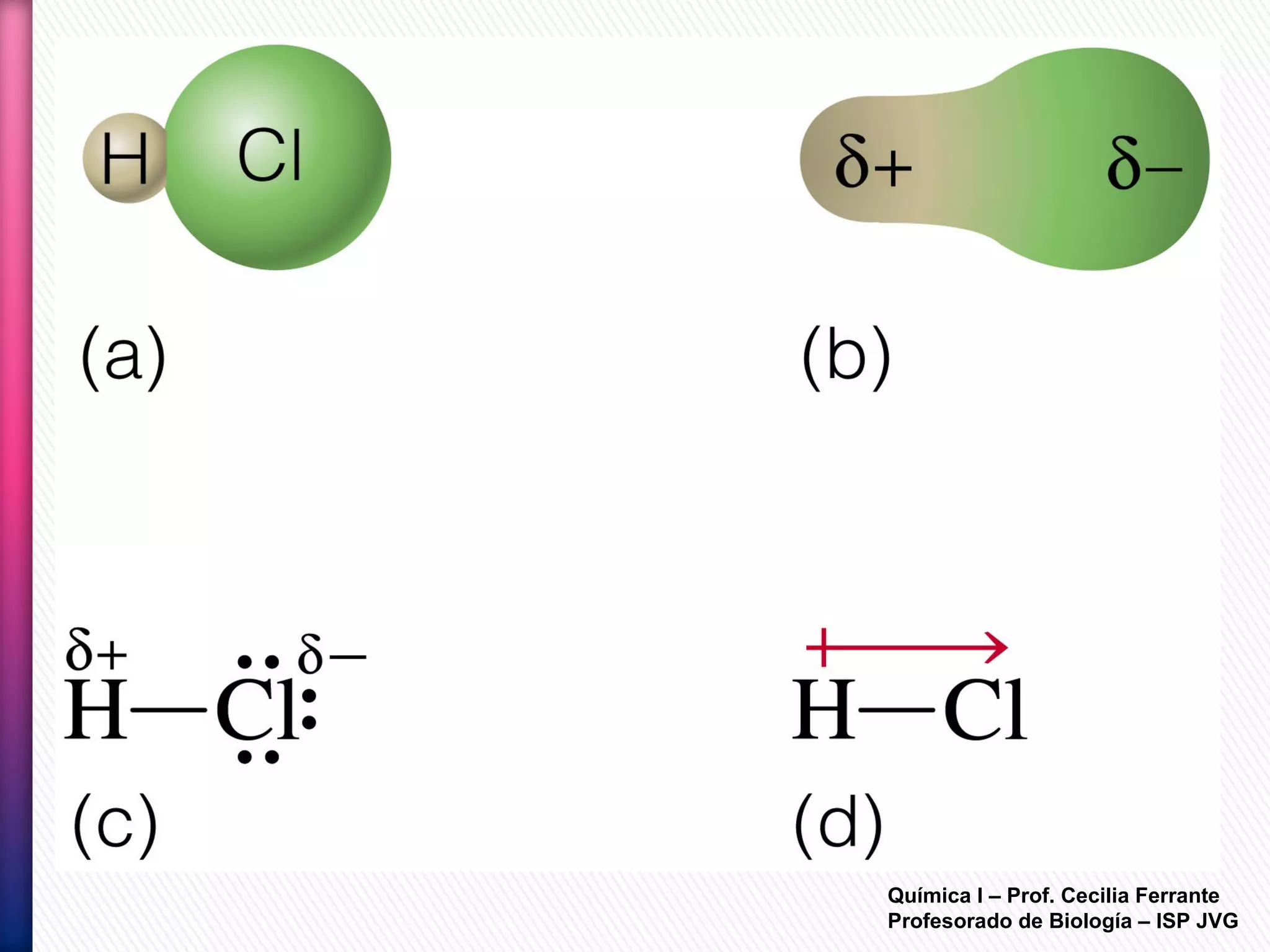
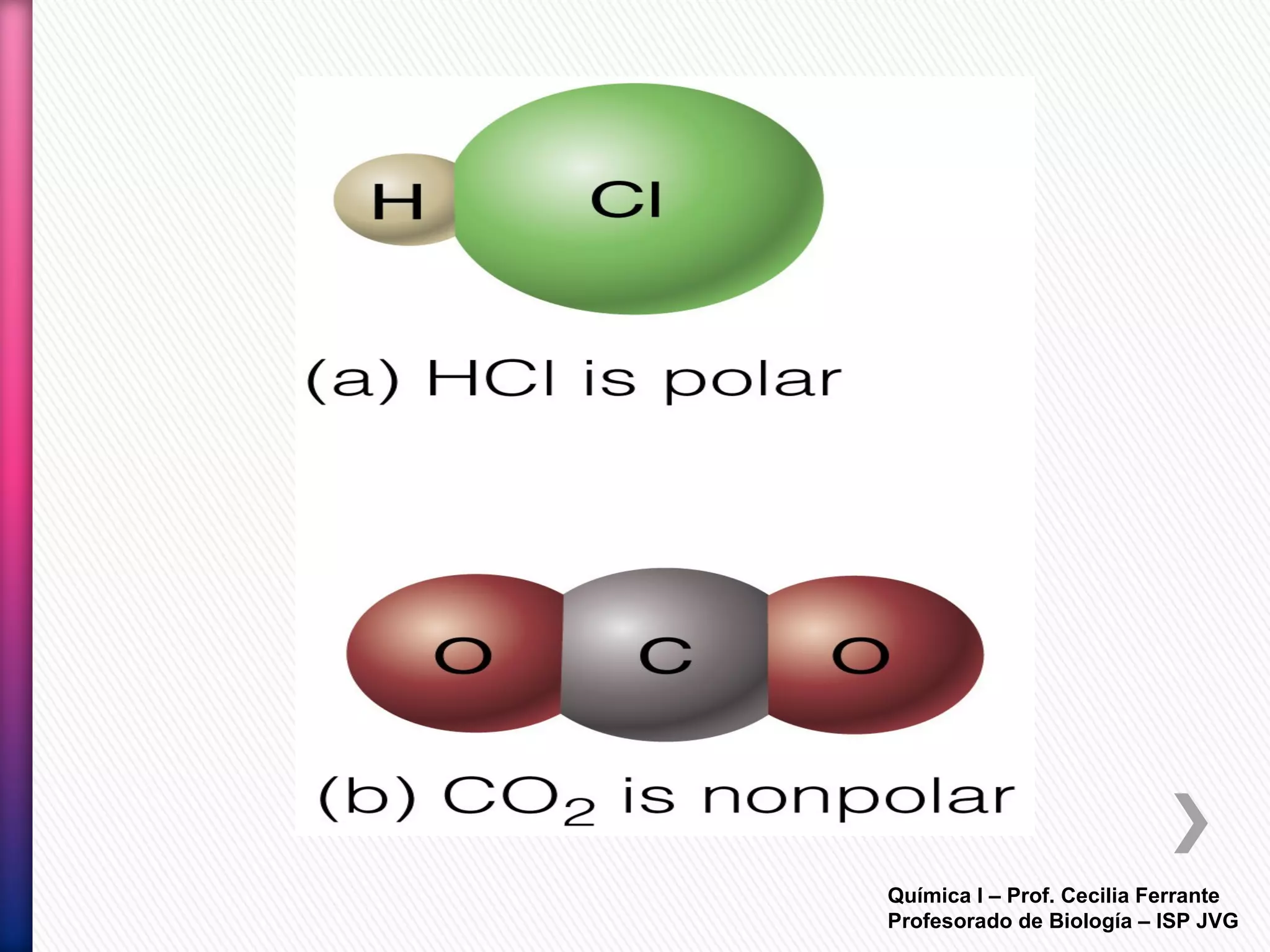
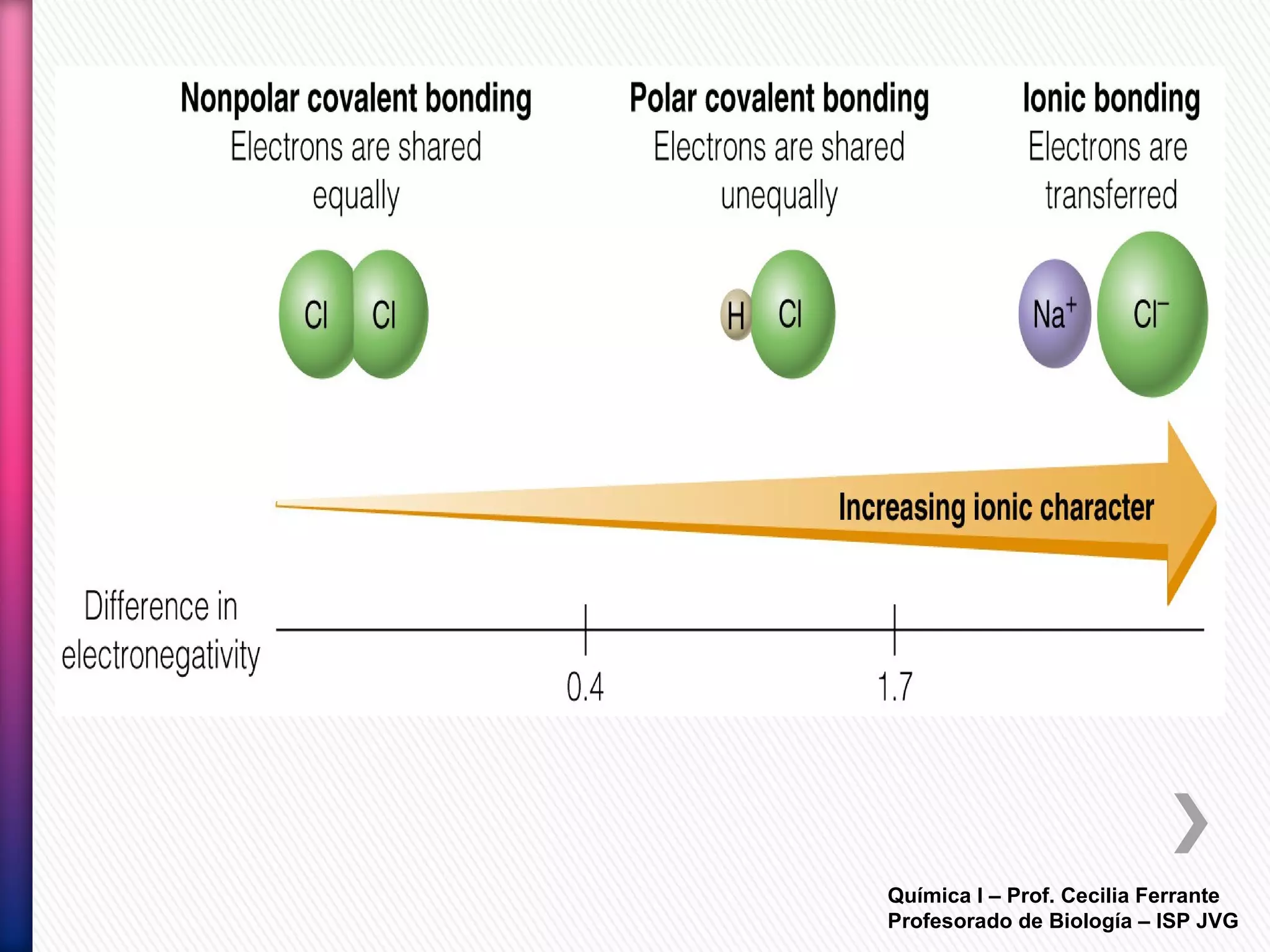
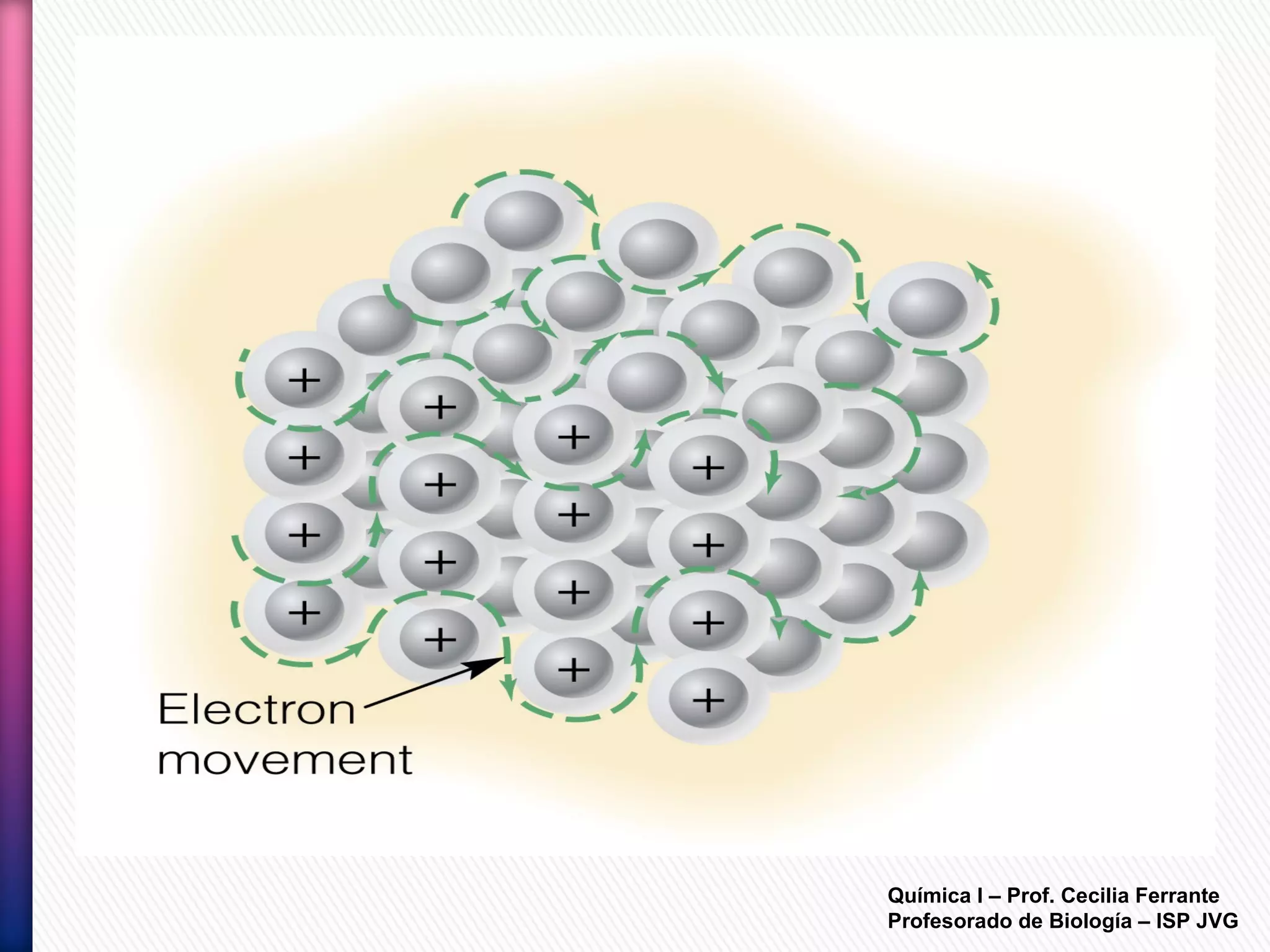
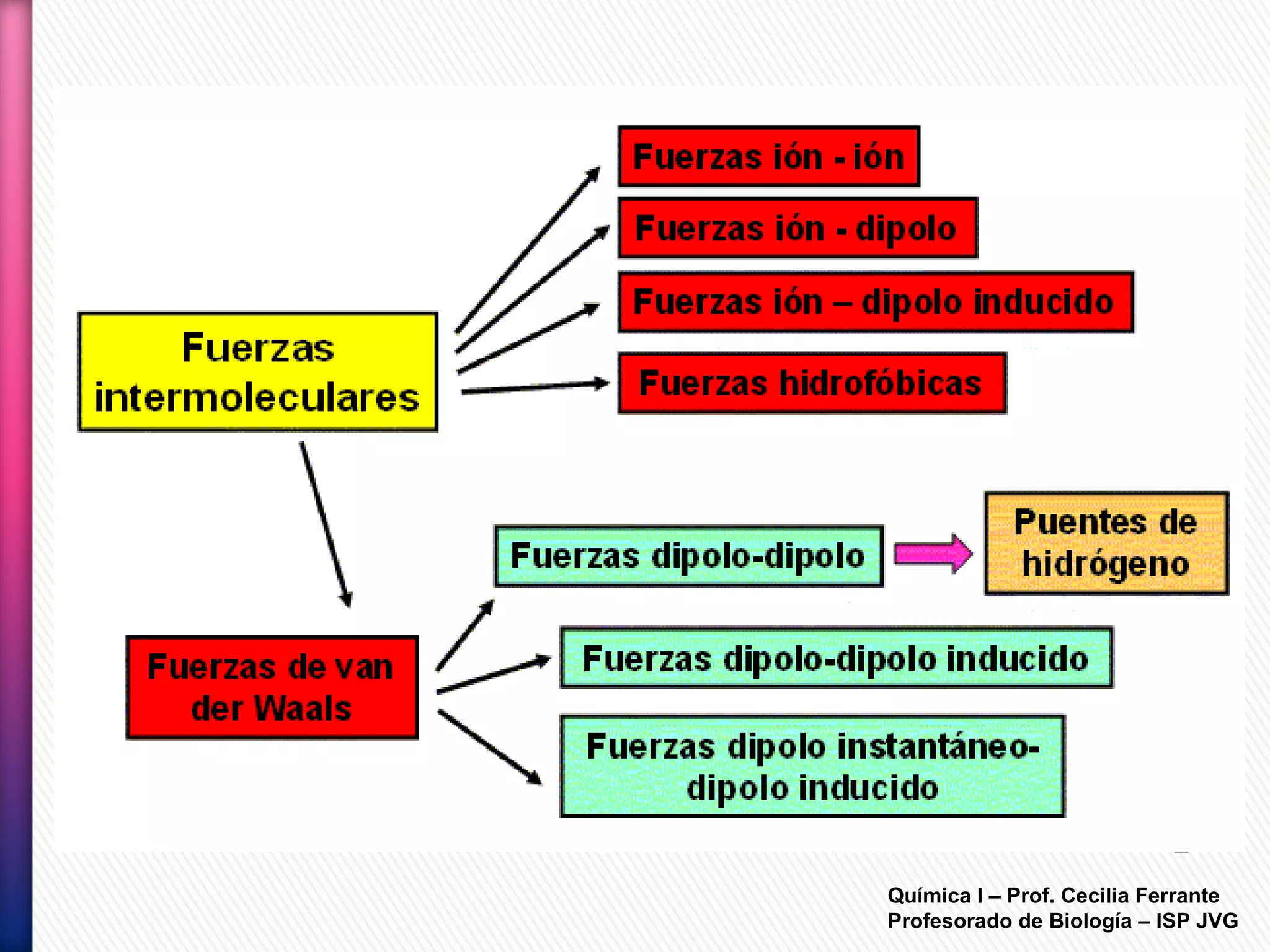
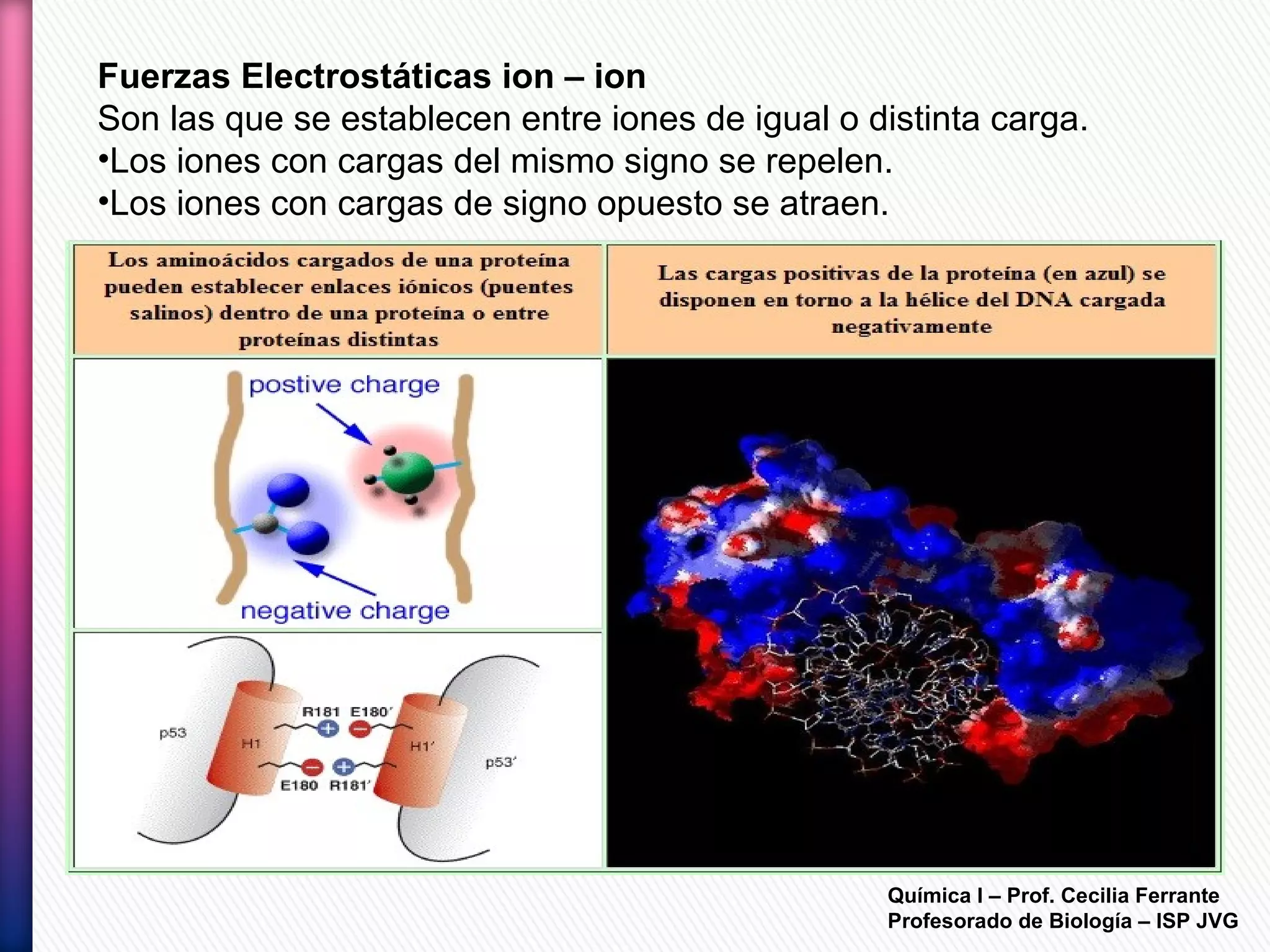
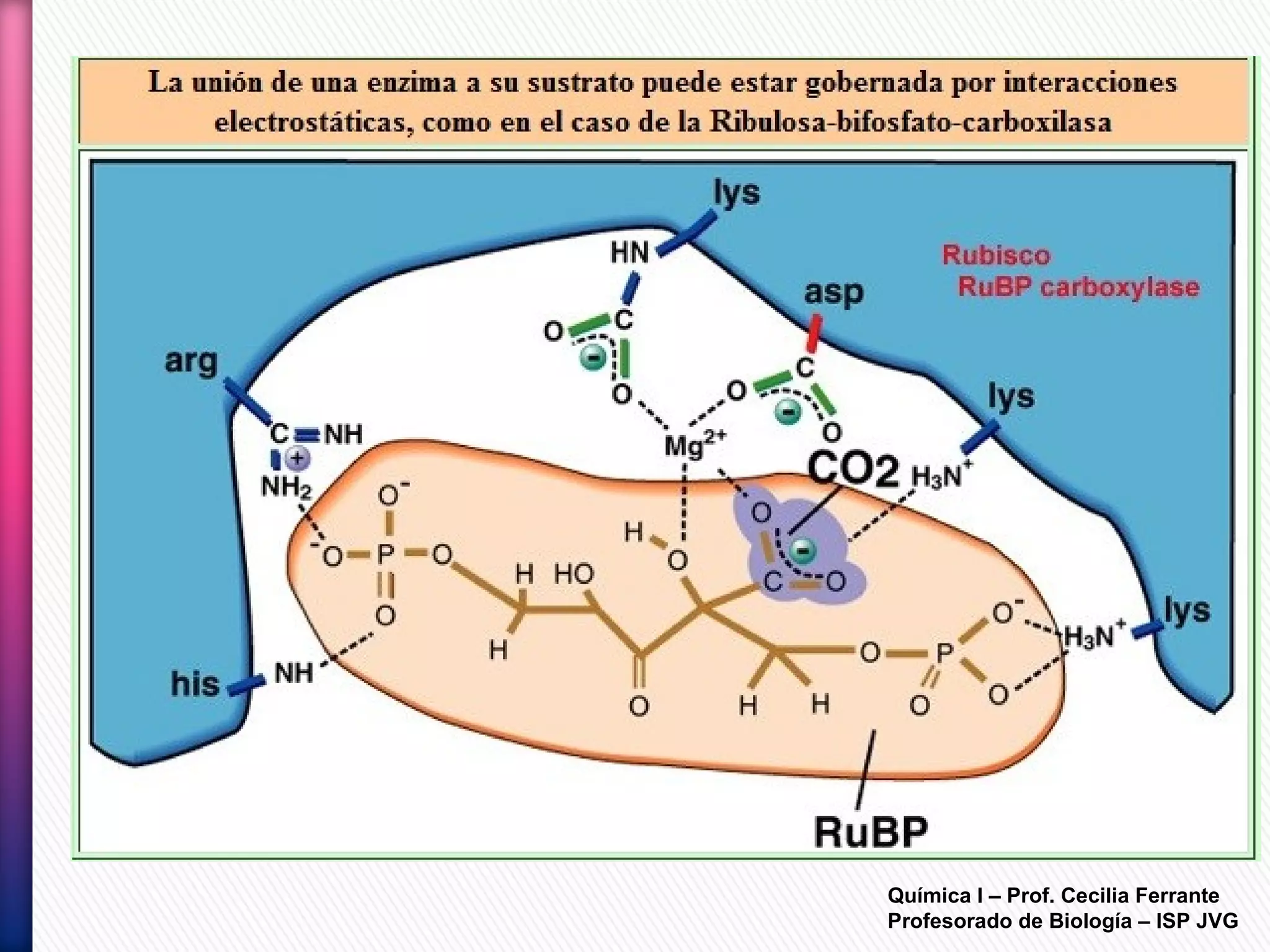
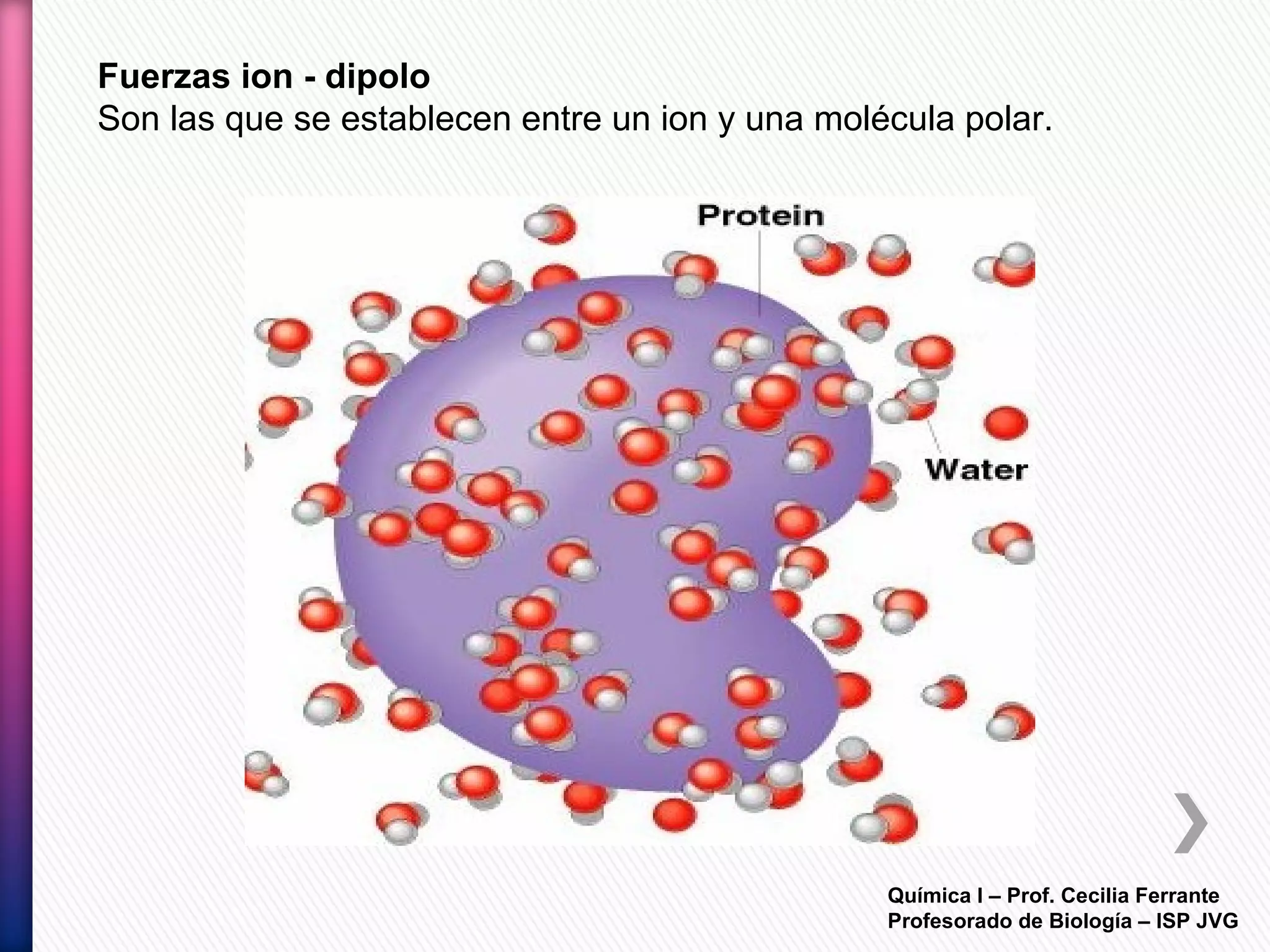
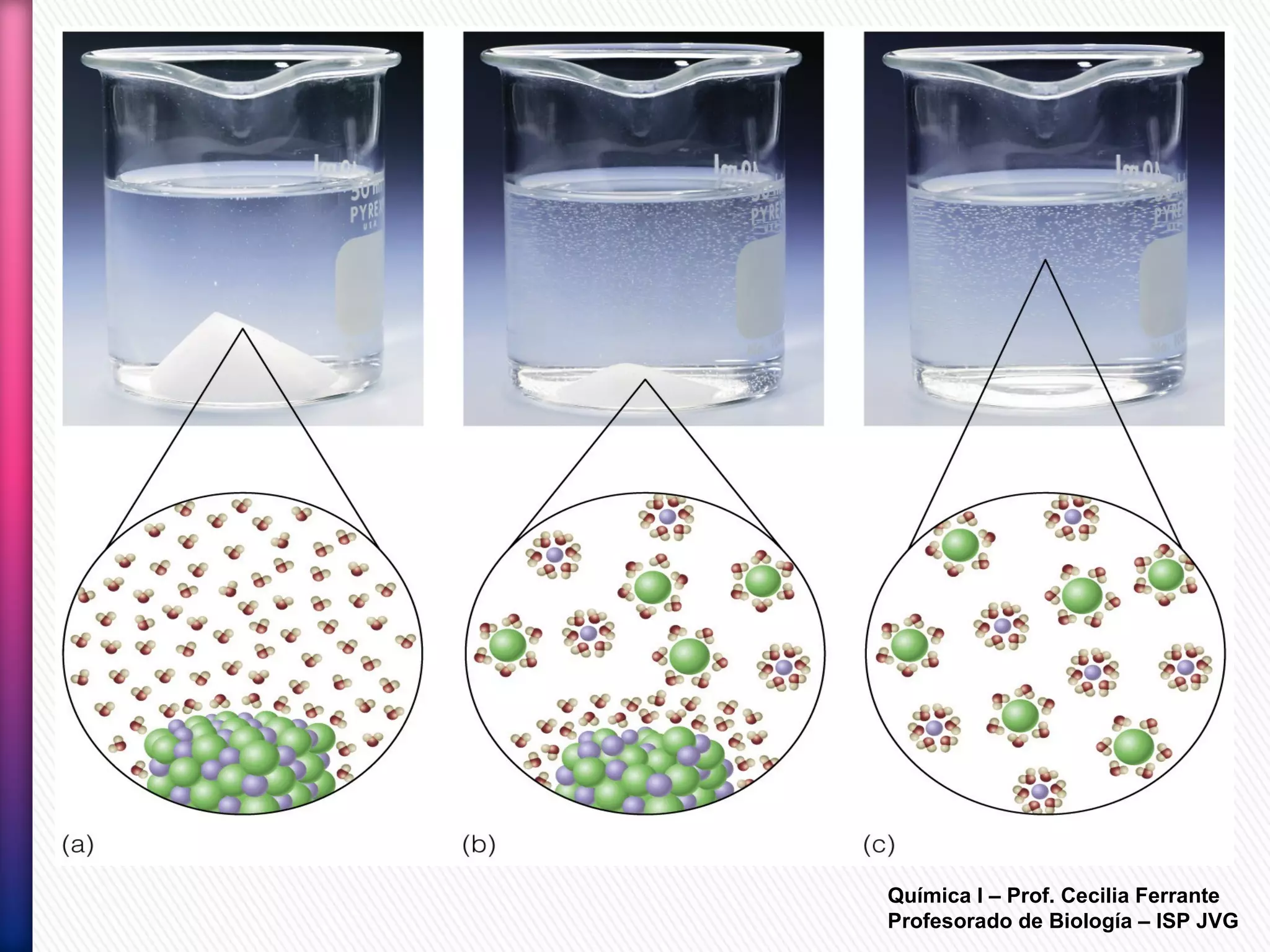
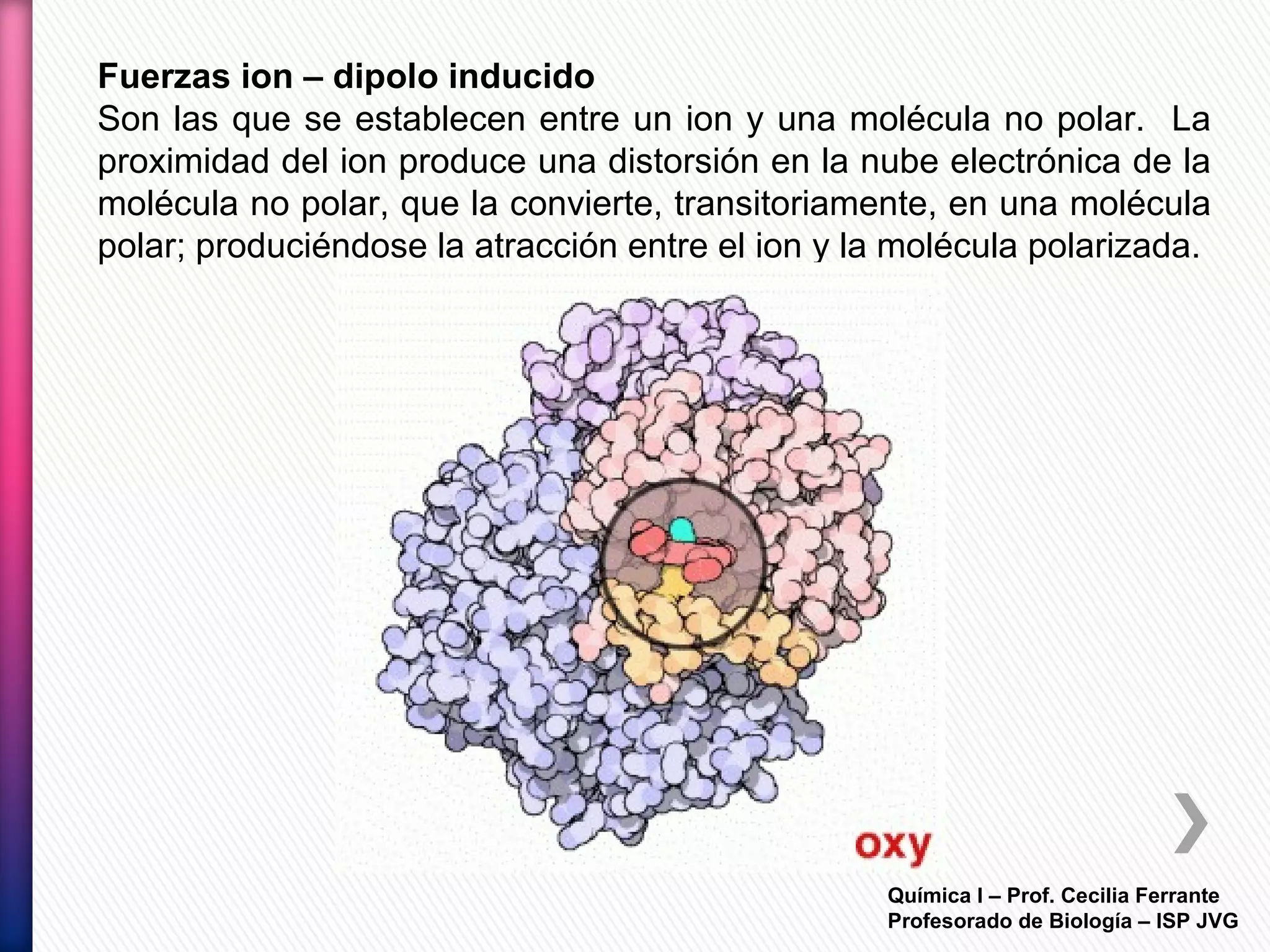
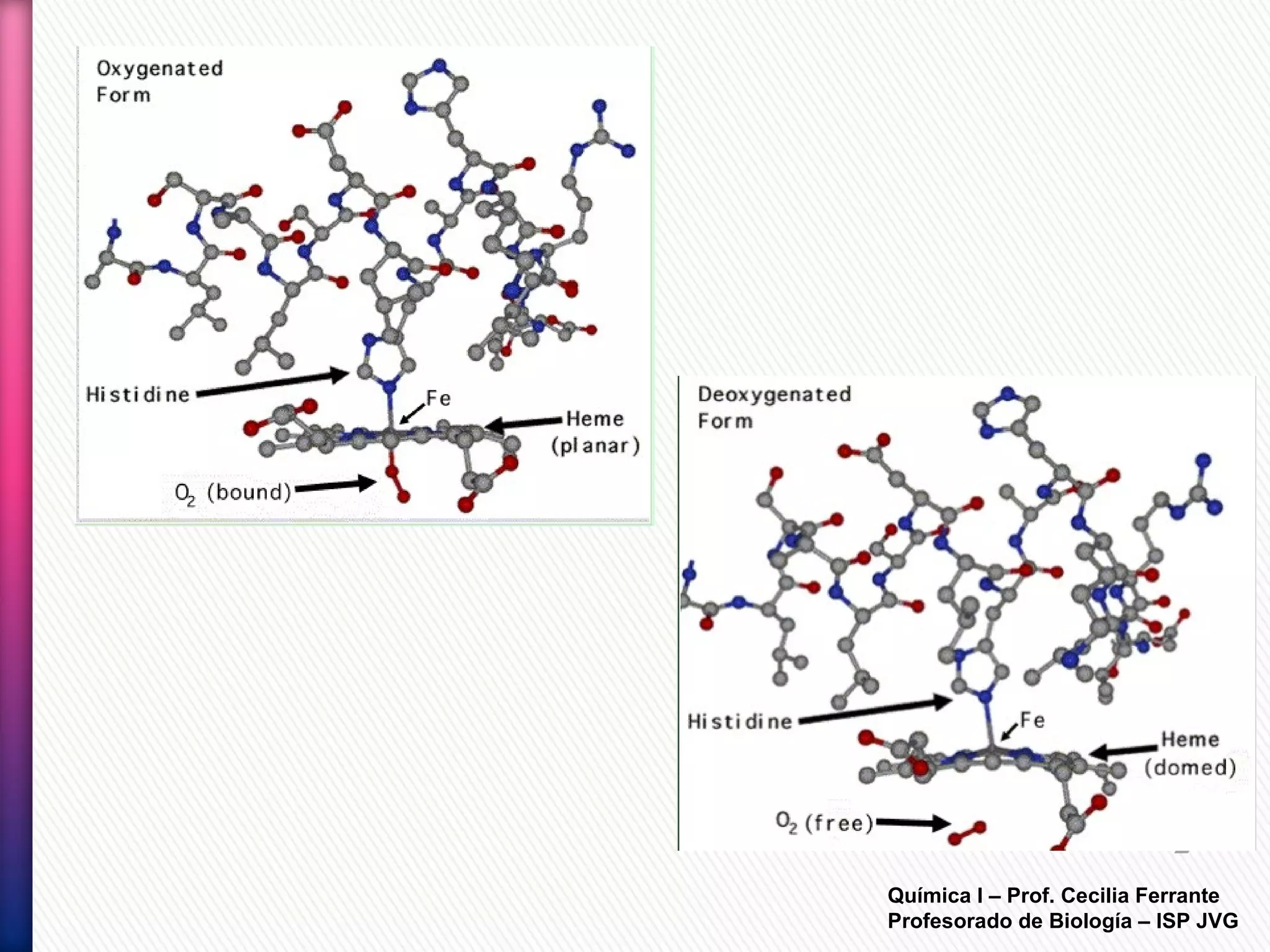
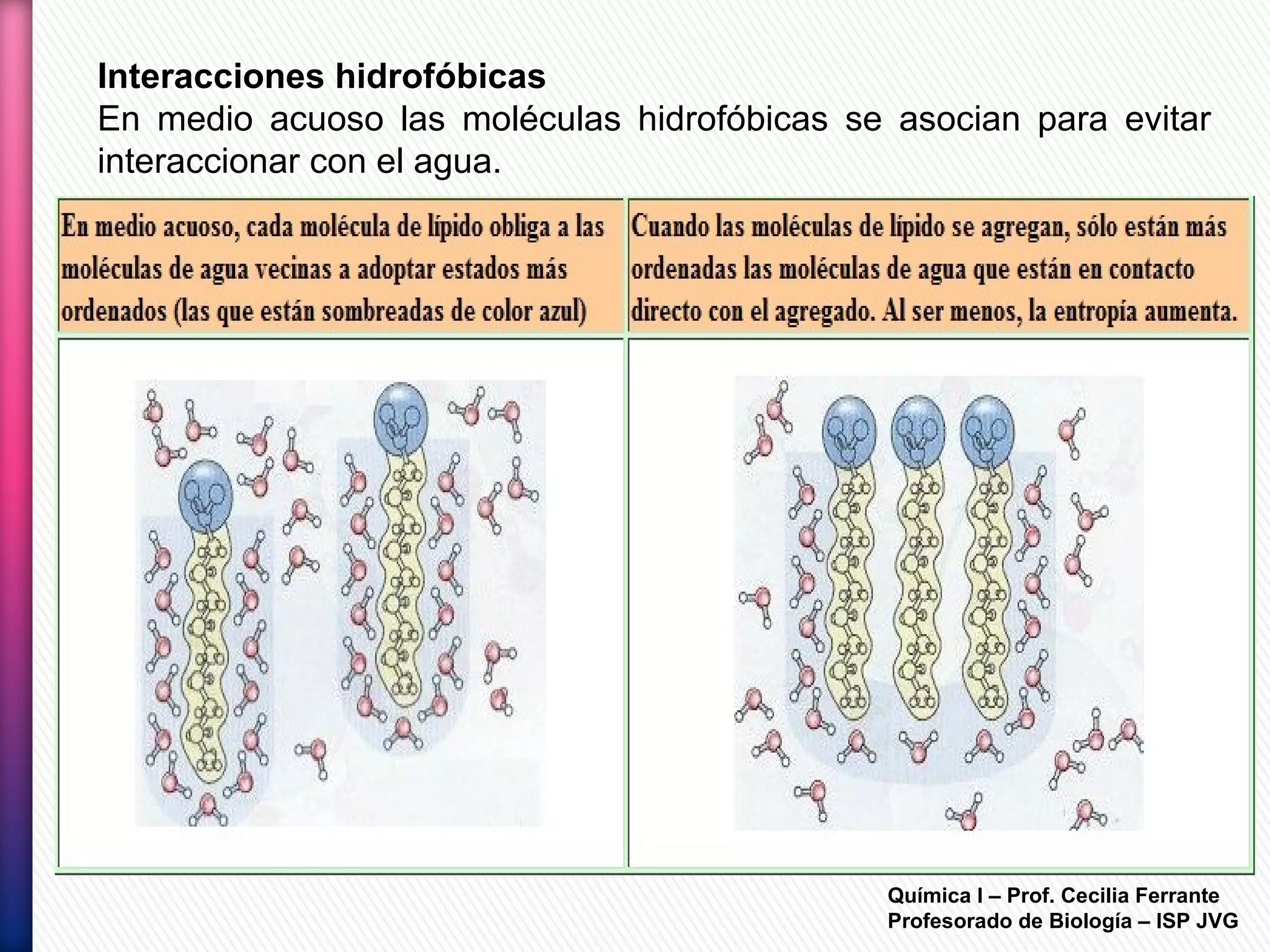
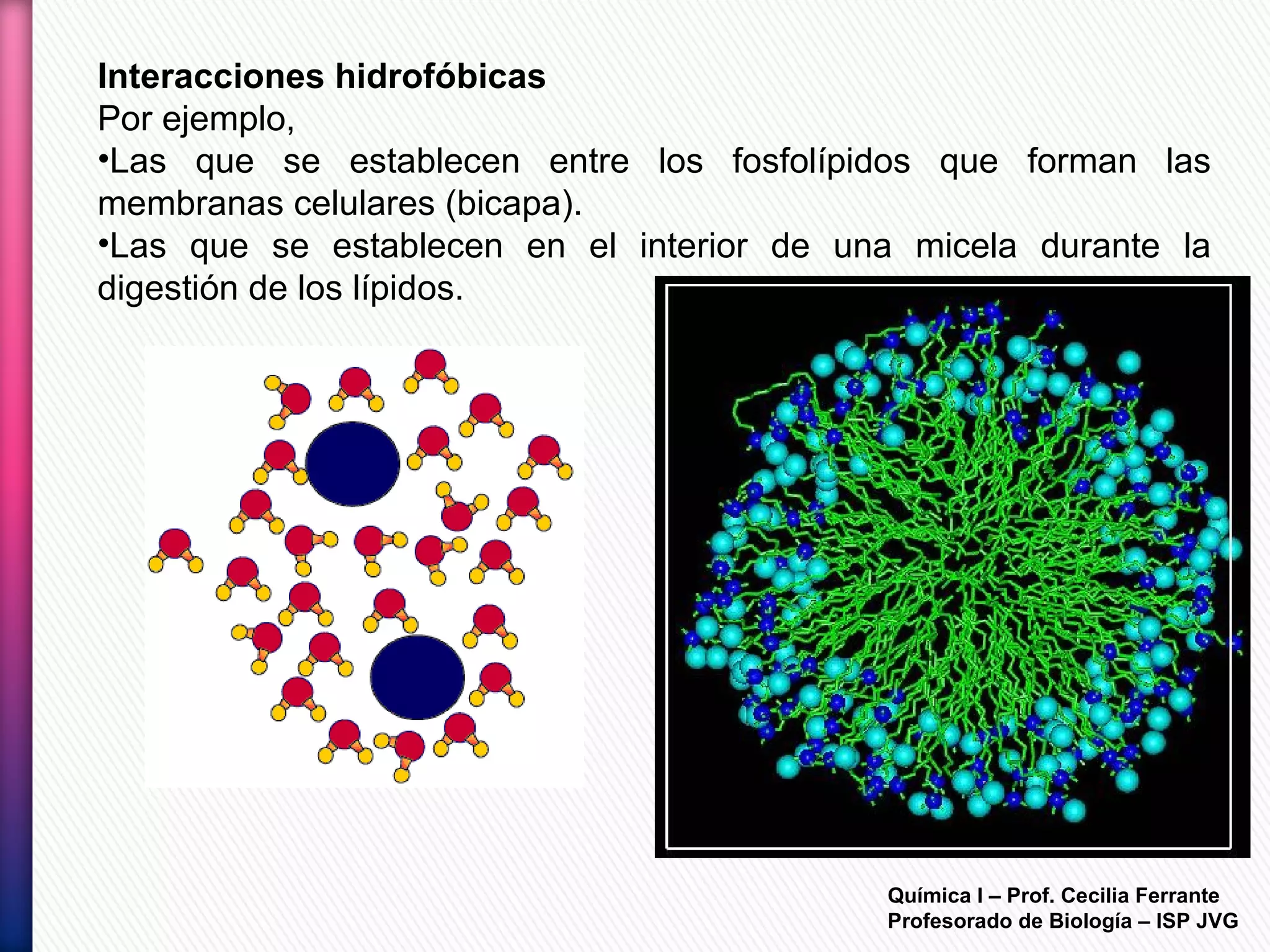
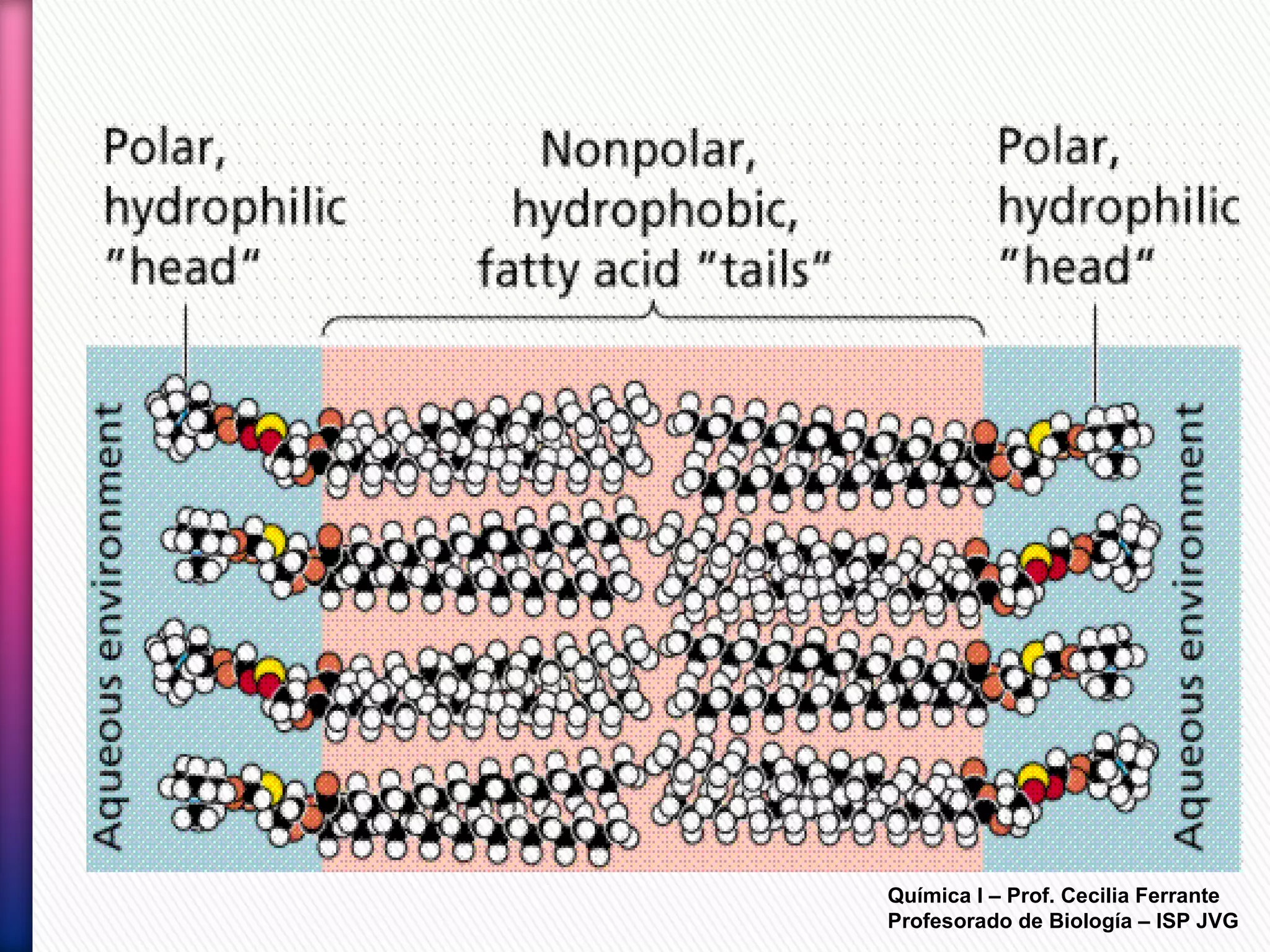
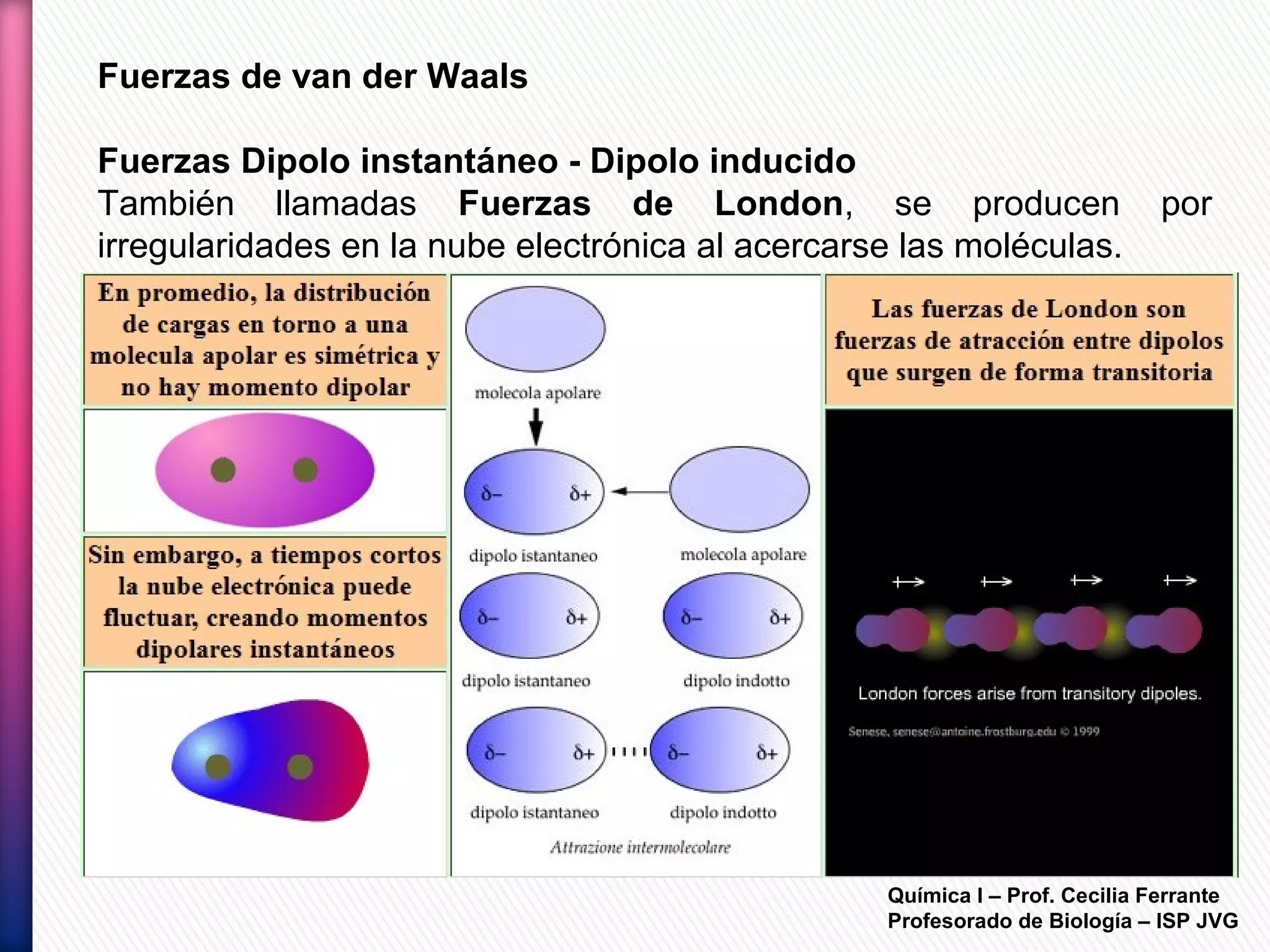
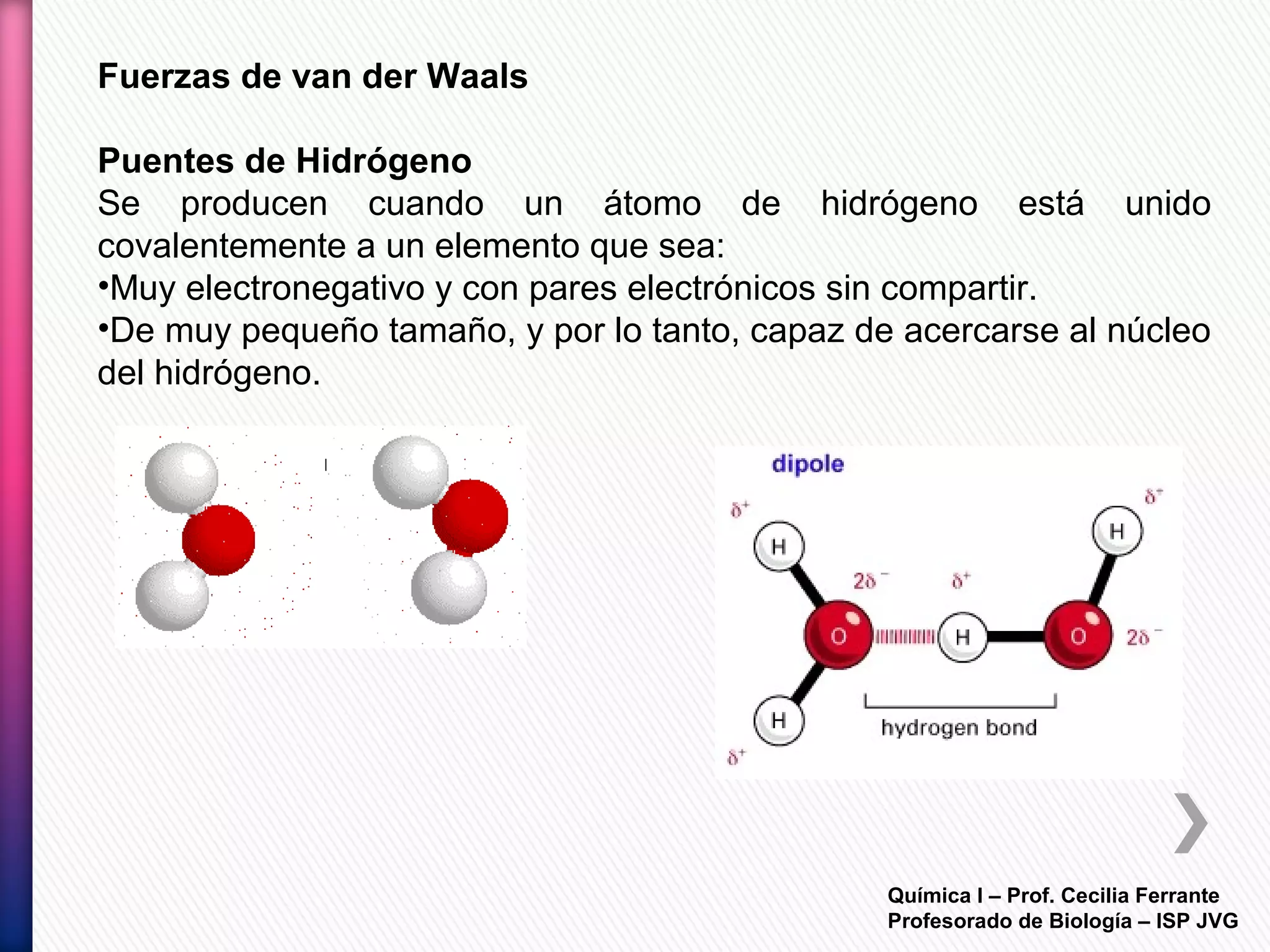
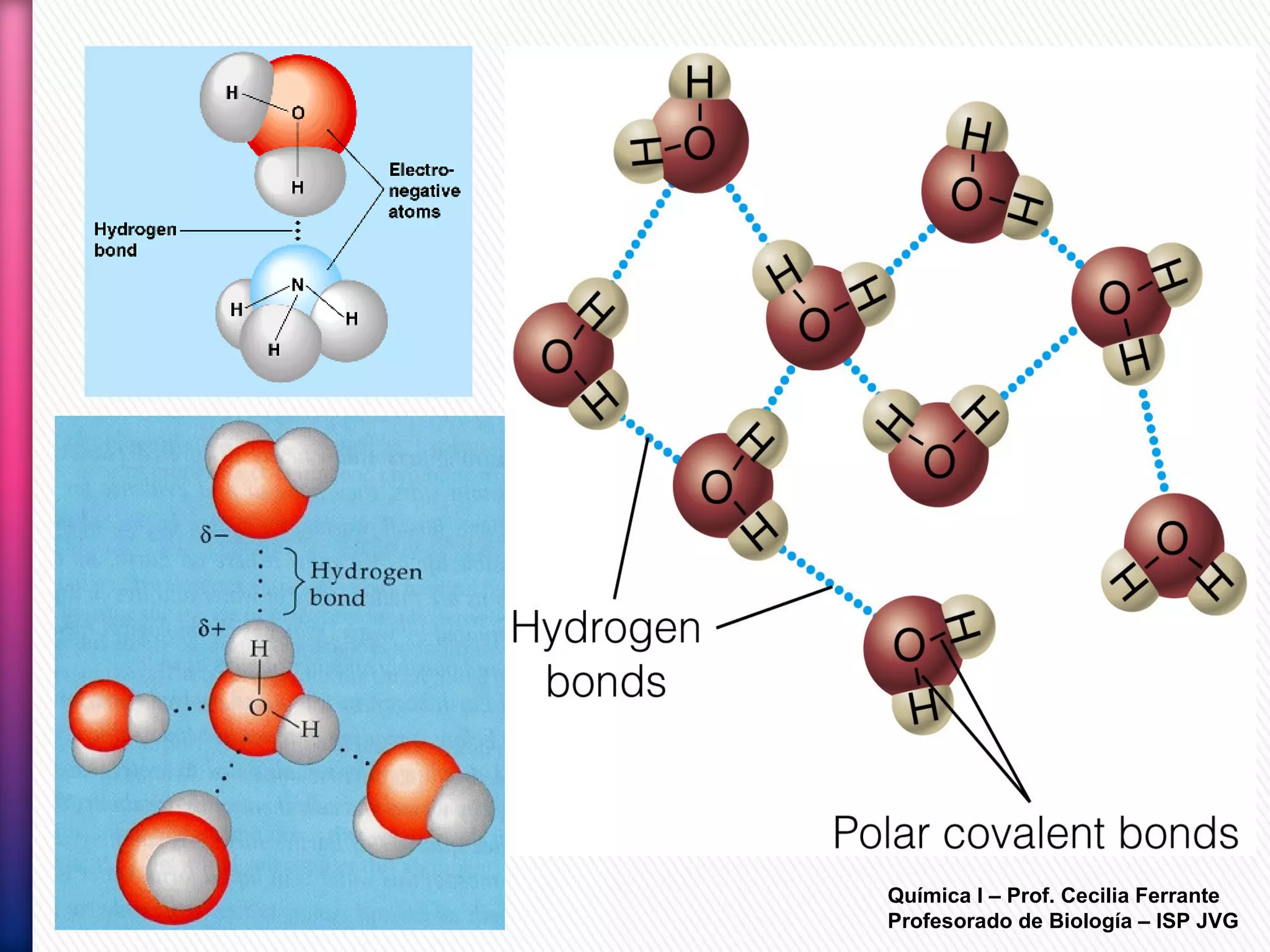
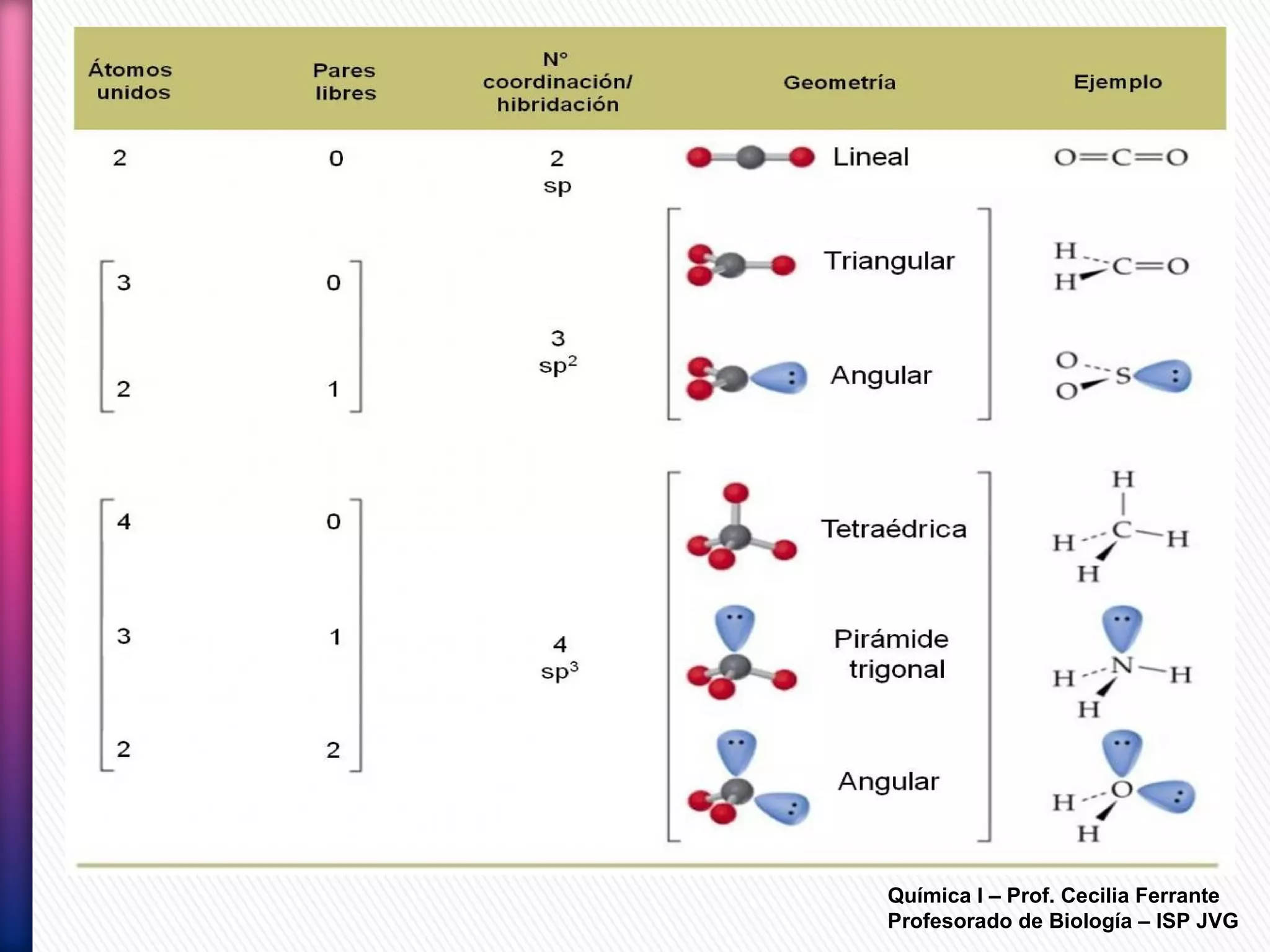
El documento resume diferentes tipos de interacciones químicas, incluyendo uniones iónicas, fuerzas de van der Waals, puentes de hidrógeno e interacciones hidrofóbicas. También explica la teoría de la repulsión de pares electrónicos de valencia y cómo esta teoría predice la geometría molecular.