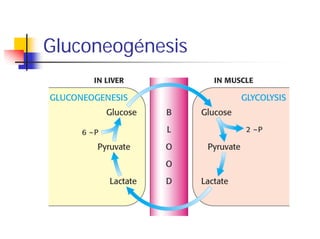
La gluconeogénesis es la síntesis de glucosa a partir de precursores no carbohidratos como lactato, aminoácidos y glicerol. Ocurre principalmente en el hígado y riñón para mantener los niveles de glucosa en sangre que necesitan el cerebro y músculos. Involucra la conversión de estos precursores a piruvato o oxalacetato, y luego a glucosa-6-fosfato y glucosa a través de varias enzimas en pasos que requieren ATP y GTP. La gluconeogénesis está