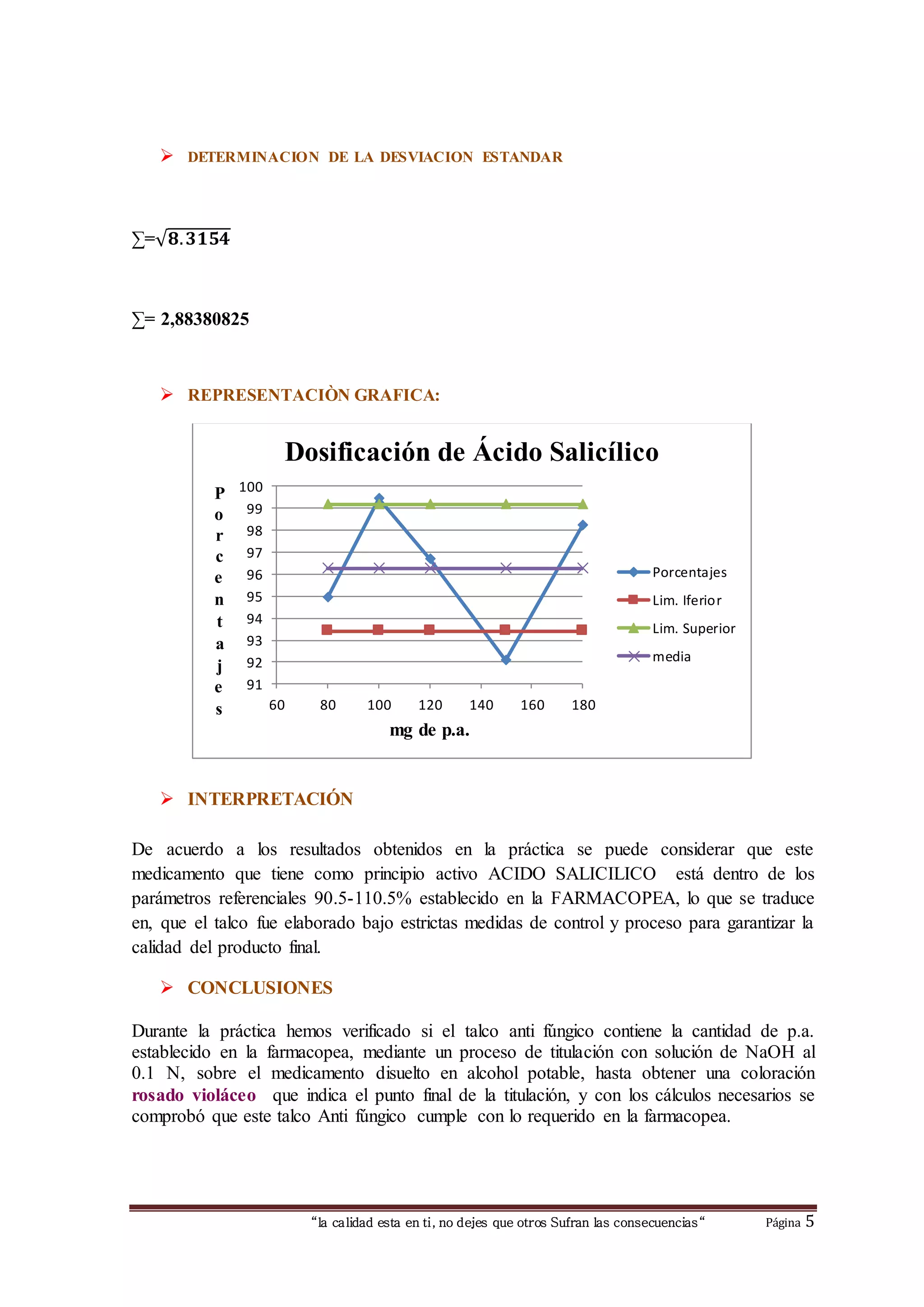
Este documento describe un experimento de laboratorio para determinar la cantidad de ácido salicílico contenida en un polvo farmacéutico mediante titulación. Los estudiantes pesaron una muestra del polvo, la disolvieron en alcohol, y titularon la solución con hidróxido de sodio usando fenolftaleína como indicador. Los cálculos mostraron que la cantidad de ácido salicílico estaba dentro de los límites de referencia establecidos, indicando que el producto cumple con los estándares de calidad.




![ RECOMENDACIONES
Utilizar el equipo de protección adecuado: bata de laboratorio, guantes, mascarilla.
Tener en cuenta el material a usar evitando contaminación de reactivos.
Realizar correctamente el proceso de triturado
Colocar una hoja papel bond como base para observar correctamente el cambio de
coloración en la titulación.
Realizar la titulación con movimiento circular, agitación continua y gota a gota.
CUESTIONARIO
¿QUÉ ES EL ÁCIDO SALICÍLICO?
El ácido salicílico (o ácido 2-hidroxibenzoico) recibe su nombre de Salix, la denominación
latina del sauce de cuya corteza fue aislado por primera vez.3 Se trata de un sólido incoloro
que suele cristalizar en forma de agujas. Tiene una buena solubilidad en etanol y éter[cita
requerida]. Este producto sirve como materia prima para la obtención del ácido
acetilsalicílico, comercialmente conocido como Aspirina.
¿CUÁLES SON LOS USOS MÉDICOS Y COSMÉTICOS?
Usos médicos y cosméticos
El ácido salicílico es el aditivo clave en muchos productos para el cuidado de la piel
diseñados para tratar acné, psoriasis, callosidades (el endurecimiento de la piel por presión
persistente), la piel de gallina y las verrugas. Trata el acné causando que las células de la
piel se caigan más fácilmente, evitando que los poros se tapen. Este efecto en las células de
la piel también hace que el ácido salicílico sea un ingrediente activo en varios champús
diseñados para tratar la caspa. El uso directo de una solución salicílica puede causar
hiperpigmentación en piel sin tratamiento previo para aquellos con tipos de piel más
oscuros (prototipos Fitzpatrick IV, V, VI), así como con la falta de uso de un bloqueador
solar de amplio espectro.
Las propiedades medicinales del ácido salicílico (principalmente para alivio a la fiebre) se
han conocido desde 1763. La sustancia ocurre en la corteza de los sauces; el nombre ácido
salicílico se deriva de salix, el nombre en latín para los sauces.
El ácido acetilsalicílico se puede preparar a través de la esterificación del grupo hidroxil-fenólico
del ácido salicílico.
El subsalicílico en combinación con el bismuto forma un aliviante popular estomacal
conocido como el subsalicilato de bismuto (Bismutol, Pepto-Bismol, etc.). Al combinarse
los dos ingredientes claves ayudan a controlar la diarrea, la náusea, y hasta las flatulencias.
También es ligeramente antibiótico.5
Como antiséptico bucal, el ácido salicílico restituye el ácido protector de las mucosas,
ejerciendo un efecto antiséptico actuando en las mucosas afectadas de la boca y labios y es
“la calidad esta en ti, no dejes que otros Sufran las consecuencias“ Página 6](https://image.slidesharecdn.com/informe12talco-141102090610-conversion-gate02/75/Informe-12-talco-6-2048.jpg)