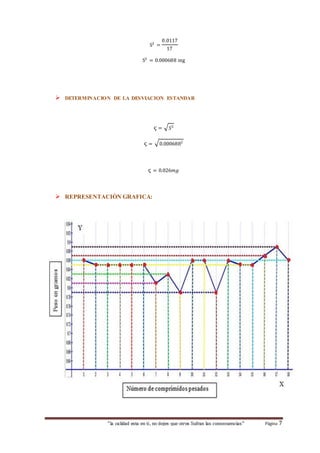
Este documento presenta los resultados de un estudio de control de calidad realizado a tabletas de aspirina. El resumen describe el procedimiento de titulación llevado a cabo para determinar la cantidad de ácido acetilsalicílico contenido y verificar que se encuentra dentro de los parámetros establecidos. Los cálculos muestran que el porcentaje de principio activo es de 98.26%, cumpliendo con los estándares requeridos.