Moleculas inorganicas
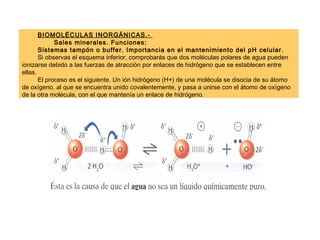
- 1. BIOMOLÉCULAS INORGÁNICAS.- Sales minerales. Funciones: Sistemas tampón o buffer. Importancia en el mantenimiento del pH celular. Si observas el esquema inferior, comprobarás que dos moléculas polares de agua pueden ionizarse debido a las fuerzas de atracción por enlaces de hidrógeno que se establecen entre ellas. El proceso es el siguiente. Un ión hidrógeno (H+) de una molécula se disocia de su átomo de oxígeno, al que se encuentra unido covalentemente, y pasa a unirse con el átomo de oxígeno de la otra molécula, con el que mantenía un enlace de hidrógeno.
- 2. ya que se trata de una solución iónica que siempre contiene algunos iones H3 O+ y OH- . En el agua pura, a 25 ºC, el producto H3 O+ x (OH_ ) = 1x 10-14 se denomina producto iónico del agua, y constituye la base para establecer la escala de pH que sirve para medir la acidez o alcalinidad de una disolución acuosa, es decir, su concentración de iones H3 O+ y OH- . La escala de pH fue ideada por el bioquímico Sorensen con el fin de evitar cálculos con número engorrosos, como 0,000001 o 1x 10-6 , que indica la baja concentración de iones H3 O+ existentes en los sistemas biológicos . Se define el pH como: pH = log 10 1/ (H3 O+ ) = log 10 (H3 O+ ) Puesto que el agua pura, a 25ºC, se considera químicamente neutra : (H3 O+ ) (OH_ ) = 1x 10-14 (H3 O+ ) = (OH_ ) = 1 x 10 –7 Por tanto, el pH del agua sería : pH = log 10 1/ 1 x 10 –7 = 7
- 3. Observa que la escala de pH es logarítmica, lo que significa que si el valor del pH de una disolución varía en una unidad, por ejemplo, disminuye de 4 a 3, la concentración de hidrogeniones aumenta 10 veces y se hace más ácida.
- 4. Los organismos vivos no soportan variaciones de pH mayores de unas décimas de unidad, y por ello han desarrollado a lo largo de la evolución sistemas tampón o buffer que mantienen el pH constante mediante mecanismos homeostáticos. Las variaciones del pH afectan en general a la estabilidad de las proteínas, en concreto influyen decisivamente en la actividad catalítica de los enzimas, pues en función del pH pueden generar cargas eléctricas que modifique profundamente su actividad biológica. Los sistemas tampón o buffer, que tienden a impedir la variación de pH cuando se añaden cantidades moderadas de iones H3 O+ o OH- , consisten en un par ácido–base conjugada que actúan como dador y aceptor de hidrogeniones, respectivamente. CUESTIONES 1. El tampón bicarbonato es común en los líquidos intercelulares, mantienen el pH en valores próximos a 7,4 gracias al equilibrio entre el ión bicarbonato y el ácido carbónico, que a su vez se disocia en dióxido de carbono y agua. Indica la fórmula del tampón bicarbonato y cómo actuaría frente a un cambio de pH ácido y básico respectivamente. 2. El tampón fosfato se encuentra en los líquidos intracelulares, y mantiene el pH en torno a 7,2 debido al equilibrio entre los fosfatos (dihidrógeno fosfato y monohidrógeno fosfato). Indica la fórmula del tampón fosfato y cómo actuaría frente a un cambio de pH ácido y básico respectivamente.