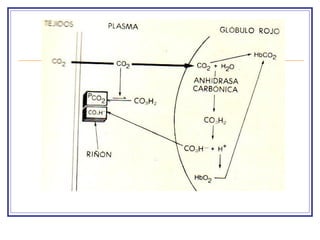
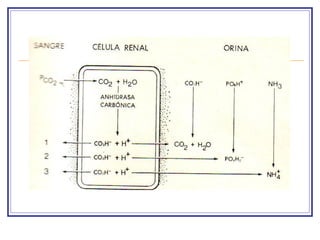
El documento explica el concepto de pH y el equilibrio ácido-base en el cuerpo. Las soluciones biológicas mantienen un estrecho rango de concentración de iones de hidrógeno para permitir funciones vitales. El pH mide la concentración de iones de hidrógeno y se regula a través de amortiguadores, la ventilación pulmonar y la filtración renal para contrarrestar la acidosis o alcalosis.