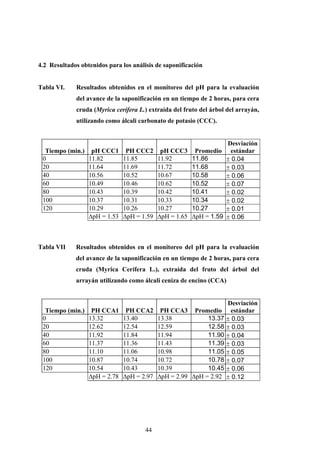
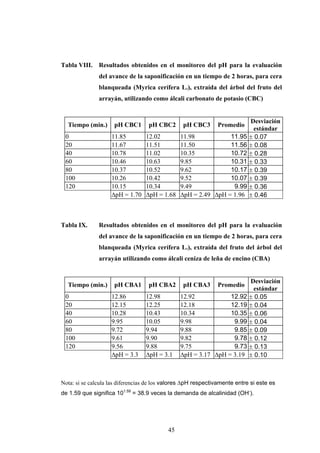
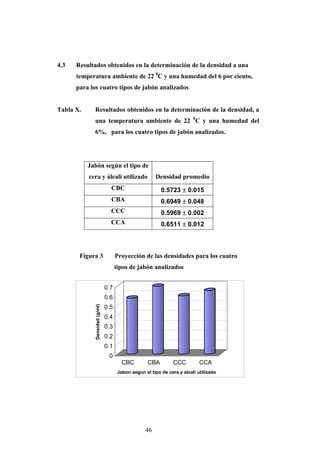
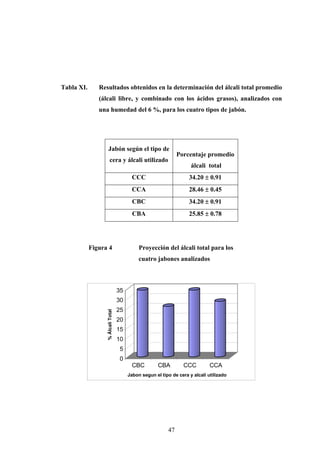
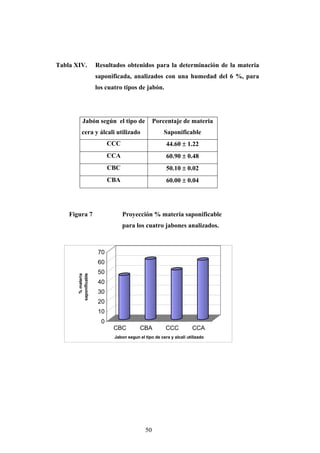
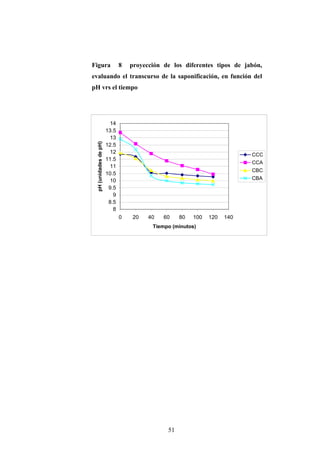
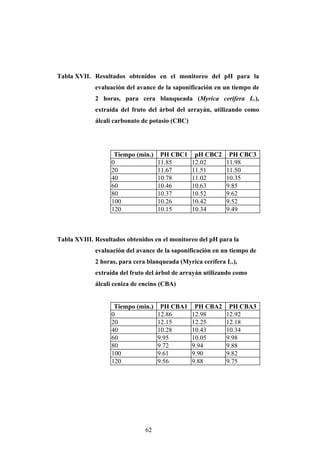
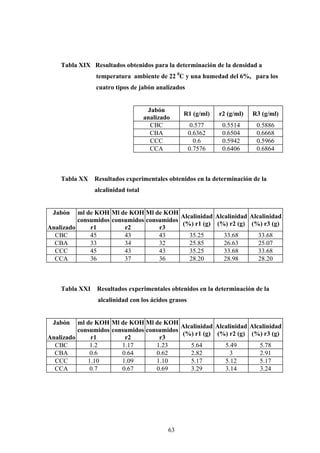
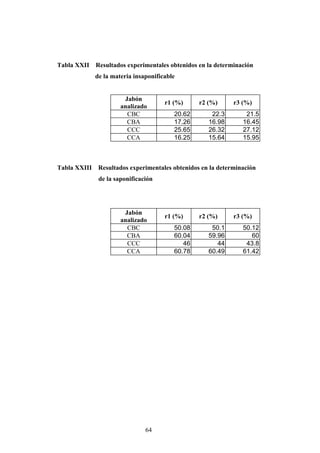
Este documento presenta un estudio sobre la saponificación de la cera del arrayán (Myrica cerífera L.) evaluando el uso de ceniza de encino como álcali alternativo en comparación con el carbonato de potasio. El estudio analizó la saponificación de la cera cruda y blanqueada usando ambos álcalis y monitoreó el pH durante el proceso. Los resultados incluyeron análisis de densidad, alcalinidad total, alcalinidad combinada con ácidos grasos y materia insaponificable de los cuatro tip