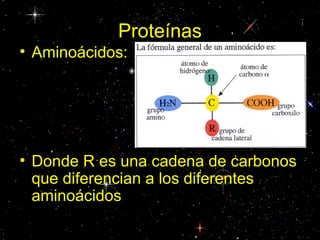
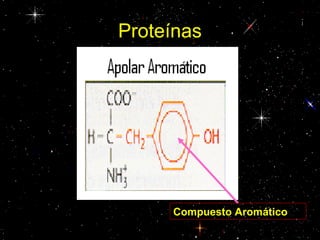
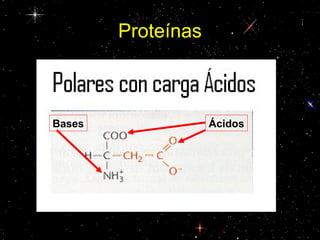
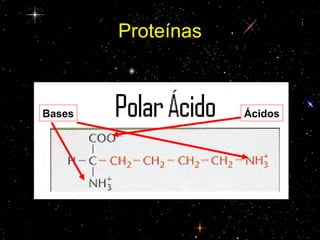
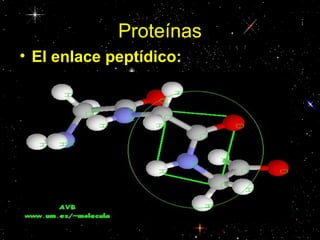
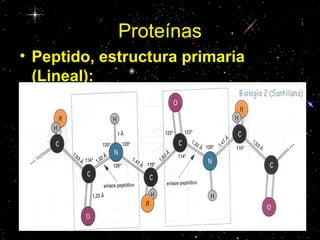
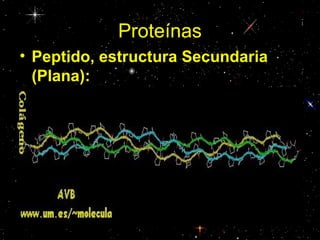
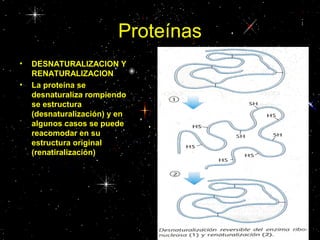
Las proteínas están compuestas principalmente por carbono, hidrógeno, oxígeno y nitrógeno. Están formadas por unidades estructurales llamadas aminoácidos. Existen dos tipos de proteínas: holoproteínas compuestas solo por aminoácidos y heteroproteínas compuestas por aminoácidos y otras moléculas. Las proteínas cumplen múltiples funciones en el cuerpo como estructural, enzimática, hormonal, reguladora, de transporte, contractil, de reserva y energética.