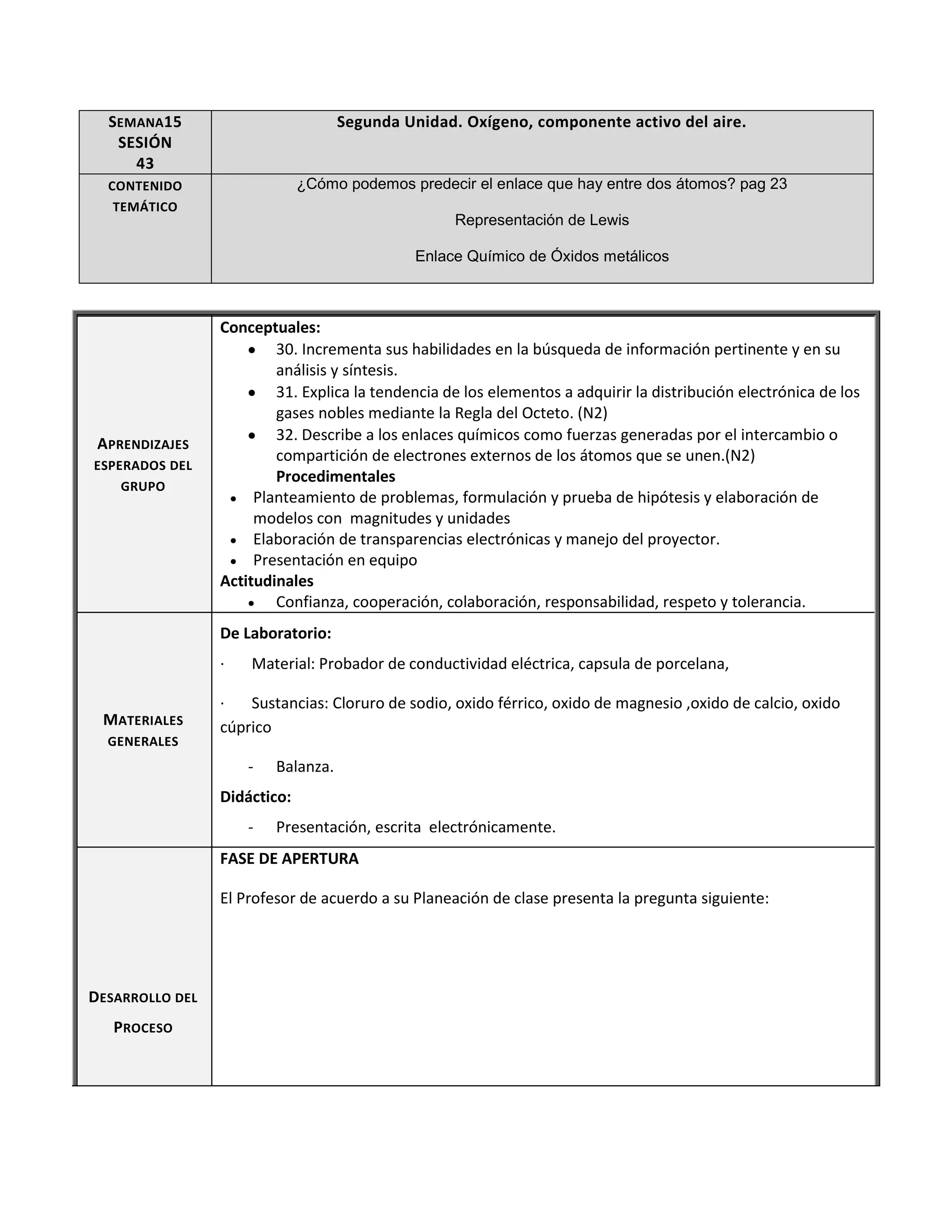
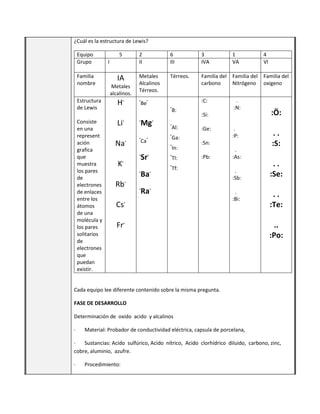
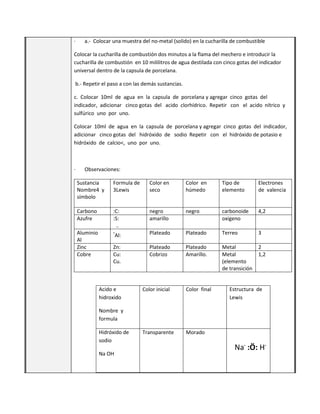
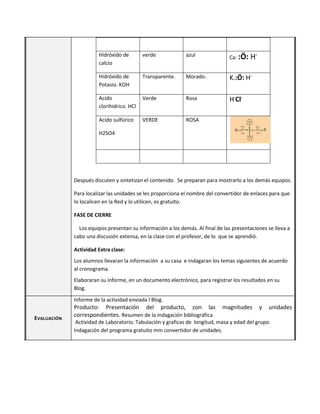
Este documento presenta la sesión 43 de la segunda unidad sobre el oxígeno. Los aprendizajes esperados incluyen explicar la tendencia de los elementos a adquirir la configuración electrónica de los gases nobles y describir los enlaces químicos. Los estudiantes aprenden sobre la estructura de Lewis, la determinación de óxidos ácidos y alcalinos, y realizan una actividad de laboratorio.