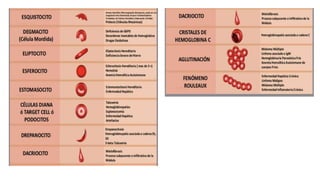
El documento describe el proceso de eritropoyesis, donde se generan eritrocitos a partir de células madre hematopoyéticas a través de diferentes etapas de diferenciación. Destaca la estructura y función de los eritrocitos, incluyendo la hemoglobina y su papel en el transporte de oxígeno y dióxido de carbono. Además, se analizan las variaciones en la eritropoyesis entre etapas fetales y adultas, así como la importante regulación por la eritropoyetina y la morfología celular.