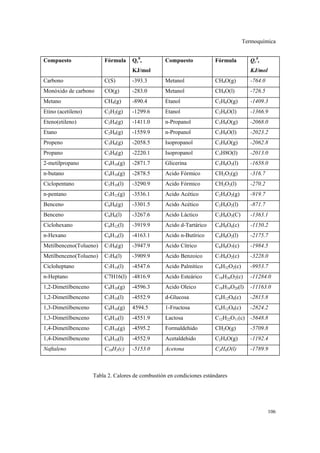
La termoquímica estudia las características de las reacciones químicas con respecto a la energía involucrada. Las reacciones pueden ser exotérmicas, liberando calor, o endotérmicas, requiriendo calor. Las ecuaciones termoquímicas especifican los estados físicos de los reactivos y productos, así como la cantidad de calor implicada.