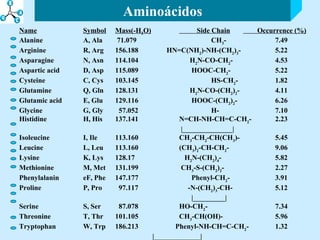
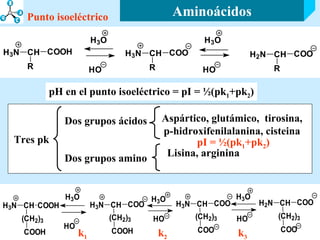
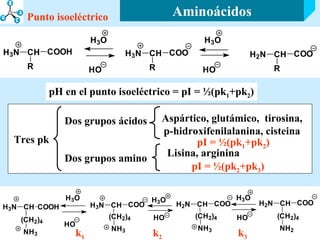
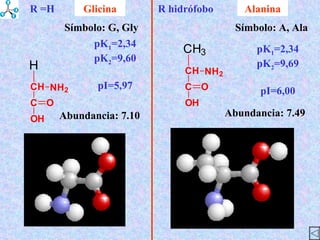
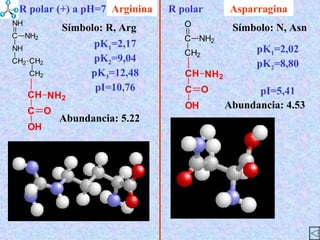
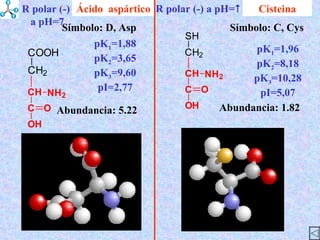
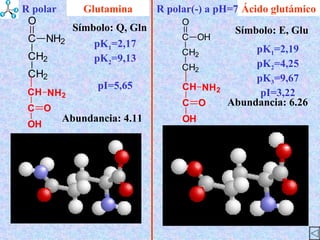
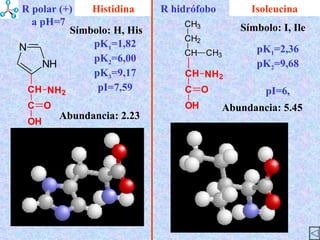
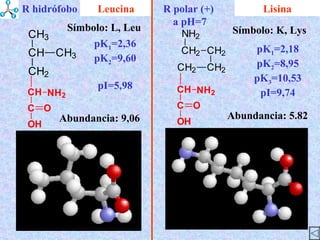
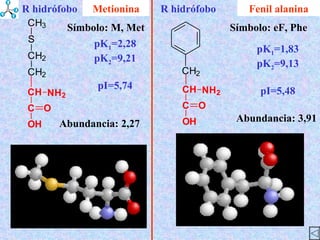
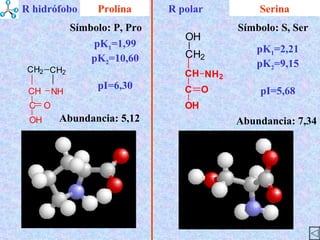
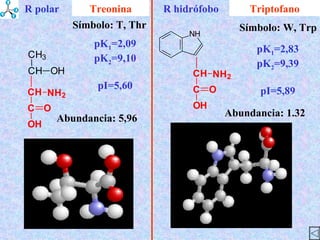
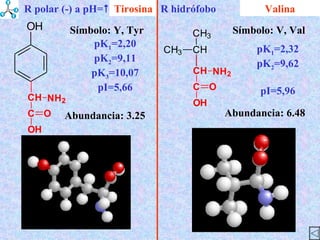
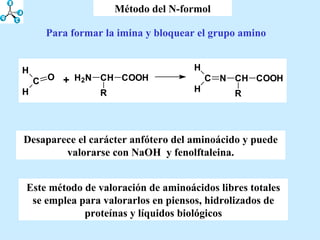
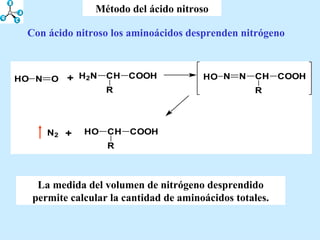
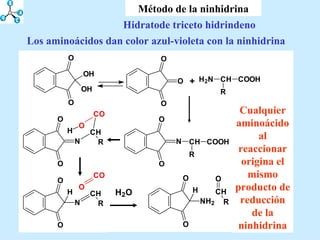
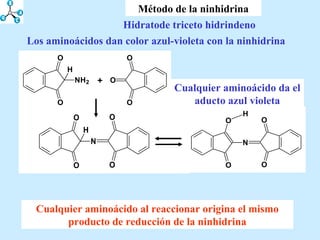
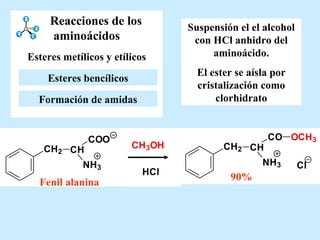
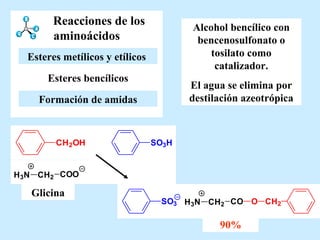
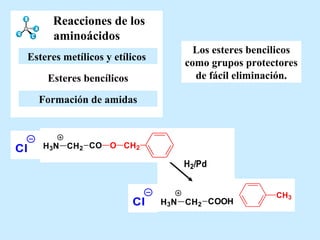
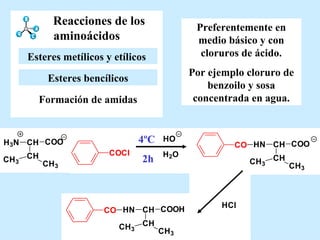
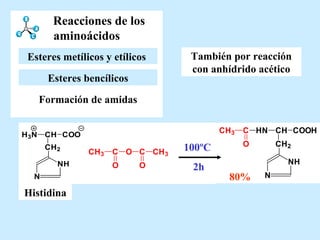
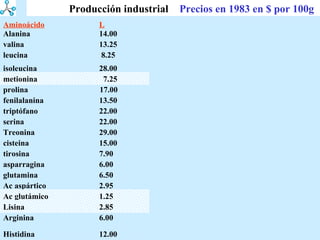
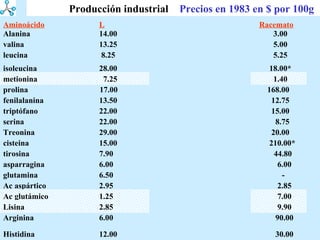
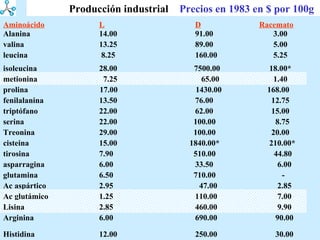
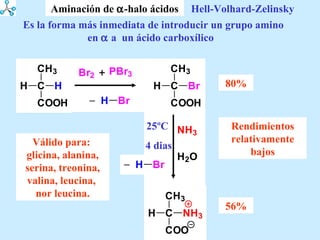
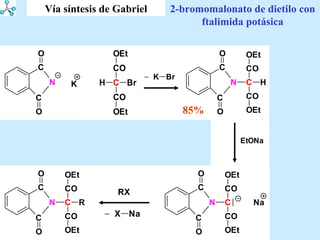
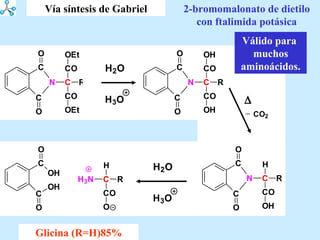
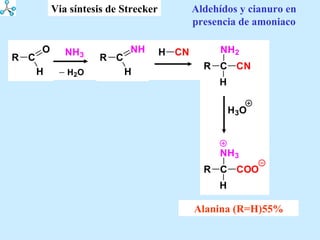
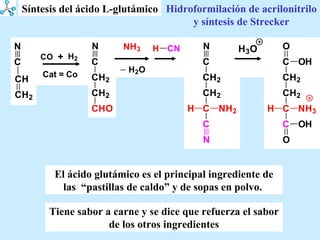
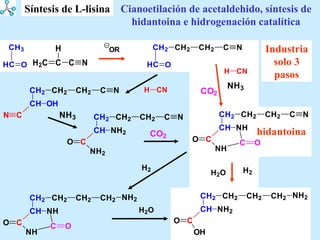
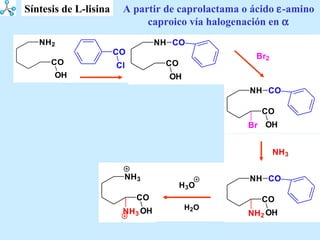
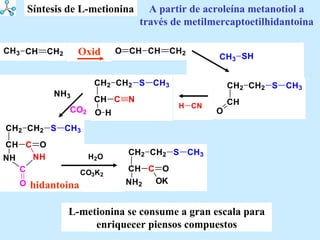
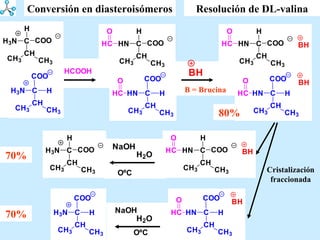
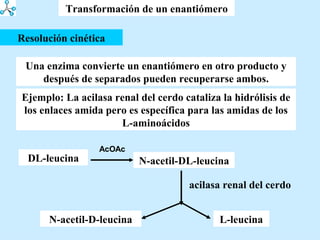
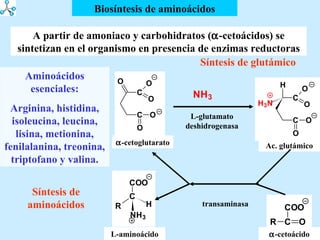
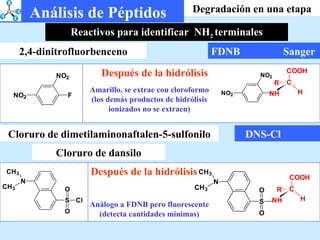
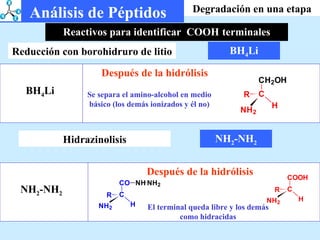
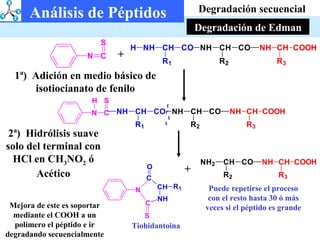
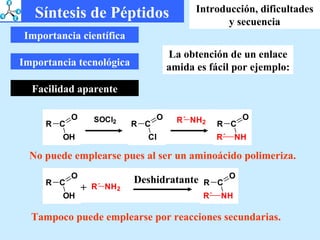
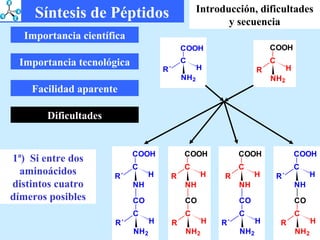
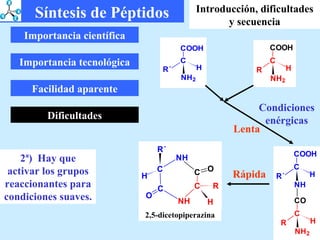
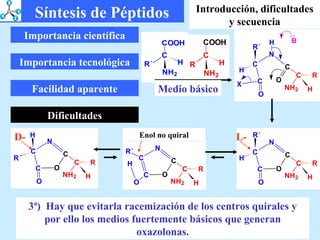
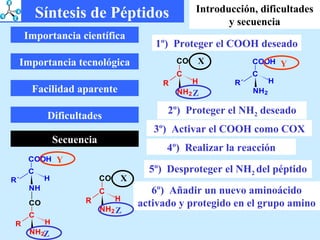
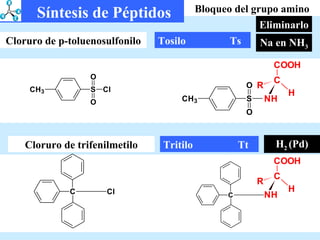
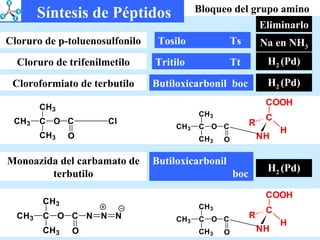
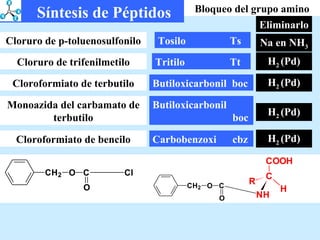
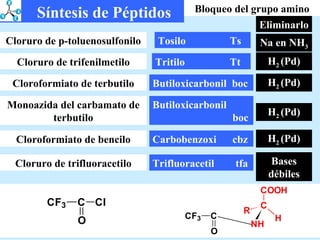
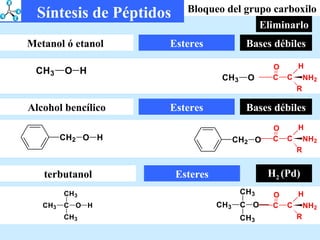
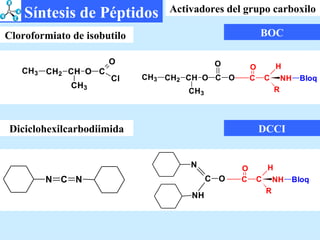
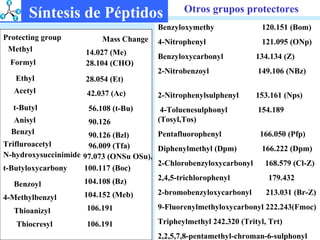
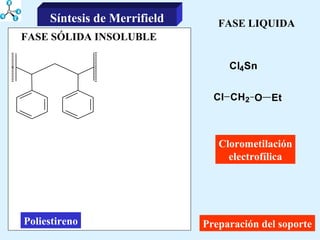
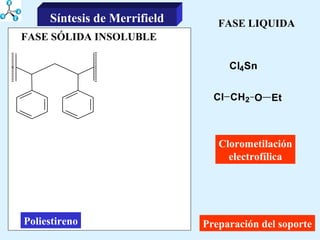
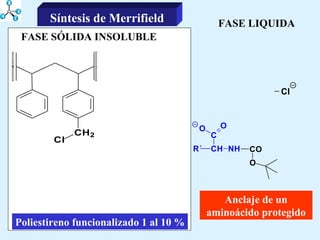
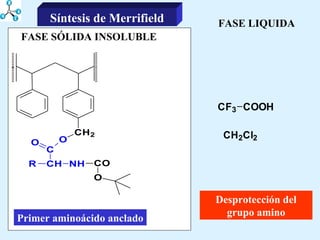
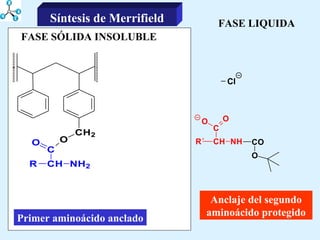
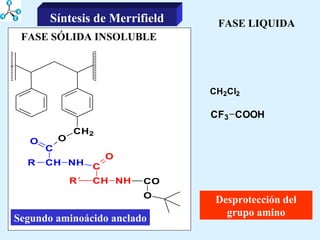
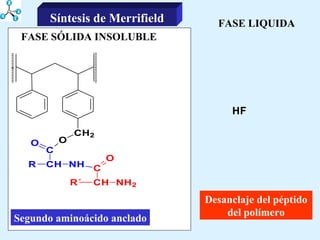
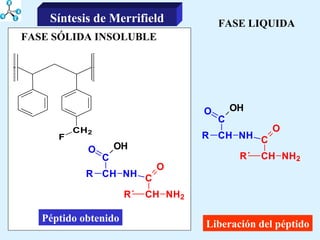
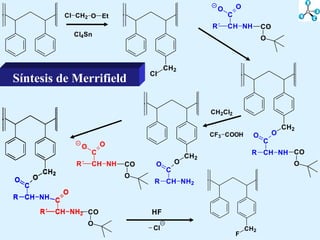
El documento describe las propiedades de los aminoácidos y los péptidos. Explica las propiedades iónicas de los aminoácidos, técnicas para su identificación como el método de N-formol y ninhidrina, y su producción a través de la hidrólisis de proteínas, síntesis química y microbiológica. También cubre las reacciones de los aminoácidos como la formación de ésteres y amidas.