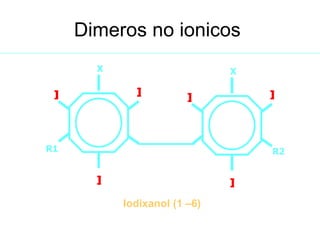
El documento describe diferentes tipos de medios de contraste radiográficos, incluyendo contrastes negativos como el aire y contrastes positivos como el sulfato de bario. Explica cómo la osmolalidad y la carga iónica afectan la toxicidad de los contrastes yodados hidrosolubles. Los contrastes no iónicos son menos tóxicos que los iónicos debido a su osmolalidad más cercana a la sangre y falta de carga eléctrica. Los contrastes de dimeros reducen aún más la osmolalidad y toxicidad en comparación con