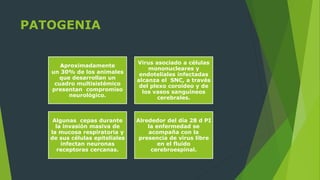
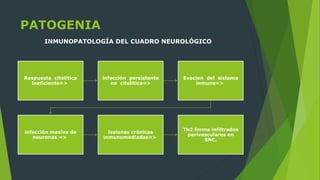
El documento describe la patogenia del virus del distemper canino. El virus ingresa a través de las mucosas y se replica rápidamente en los linfocitos, lo que causa una supresión del sistema inmune. Esto permite la diseminación sistémica del virus y el establecimiento de cuadros multisistémicos. El virus también puede infectar el SNC, causando encefalitis mediante mecanismos tanto citopáticos como inmunopatológicos que conducen a desmielinización y daño neuronal.