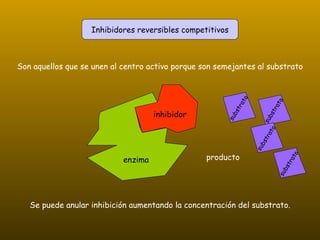
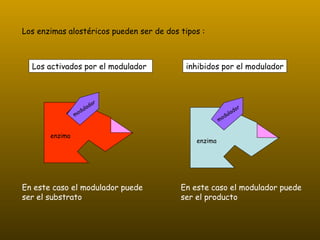
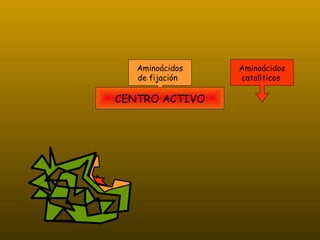
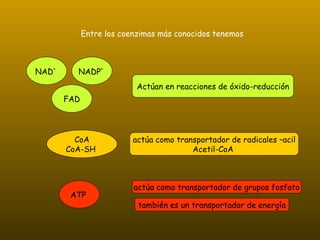
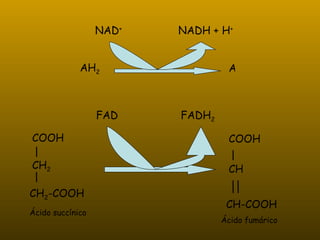
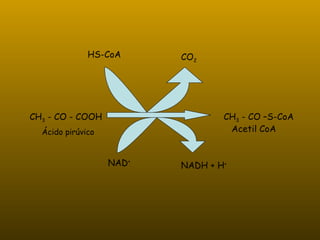
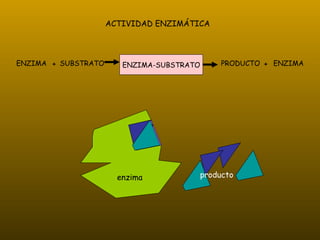
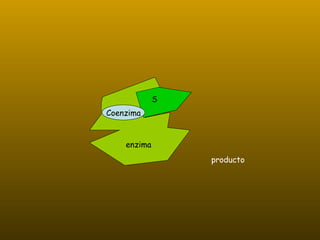
Los enzimas son proteínas que actúan como catalizadores de reacciones químicas en organismos vivos. Funcionan de forma específica y bajo condiciones suaves de temperatura y pH. Los enzimas están formados por proteínas y coenzimas como NAD+, ATP y coenzima A, que transportan grupos entre reacciones. Factores como la temperatura, pH, concentración de sustrato e inhibidores afectan la actividad enzimática.






























![Concentración del enzima Concentración del substrato La velocidad de reacción se cuantifica por el número de moléculas de substrato transformadas en la unidad de tiempo. La velocidad de una reacción enzimática aumenta según se eleva la concentración del substrato hasta alcanzar la V máx., a partir de se momento [S] V V max. se mantiene constante. La V máx. se alcanza cuando todo el enzima está ocupado por el substrato](https://image.slidesharecdn.com/enzimas2010-2011new-110701060744-phpapp02/85/Enzimas-2010-2011-new-37-320.jpg)
![Leonor Michaelis Maud Menten [S] V V max. 1/2 V max. K M CONSTANTE DE MICHAELIS-MENTEN La eficacia de un enzima se mide por la velocidad de transformación del substrato en producto. Para expresar la eficacia de un enzima se utiliza la K M que mide la afinidad del enzima por el substrato. K M constante de Michaelis-Menten, es la concentración del substrato necesaria para alcanzar la mitad de la V max.](https://image.slidesharecdn.com/enzimas2010-2011new-110701060744-phpapp02/85/Enzimas-2010-2011-new-38-320.jpg)