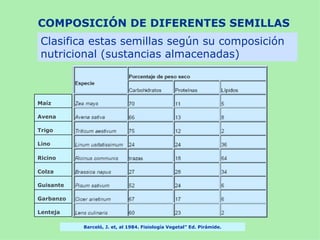
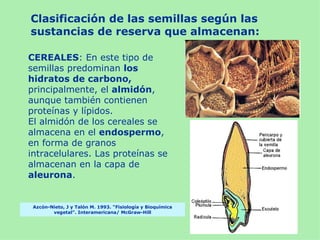
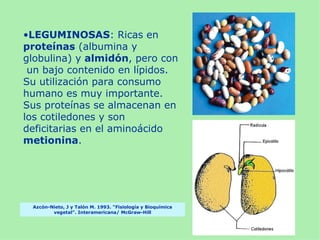
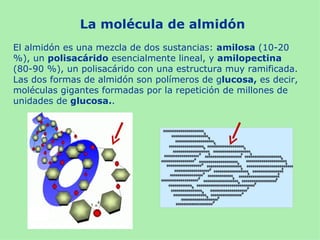
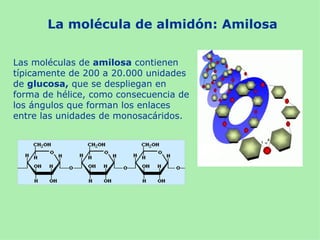
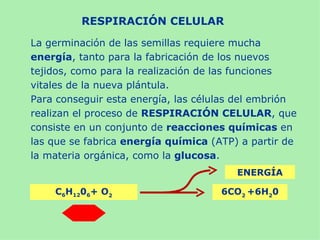
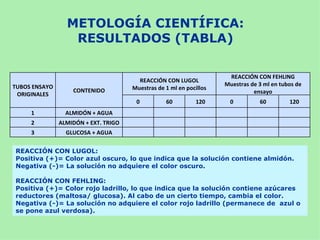
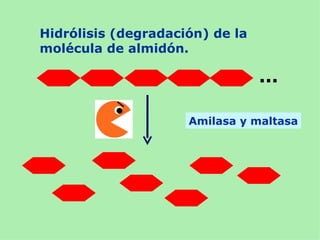
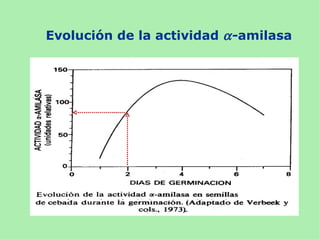
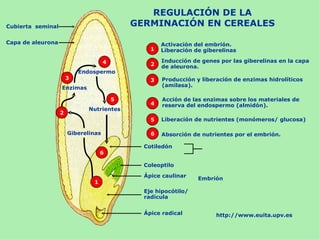
Este documento presenta información sobre un experimento para estudiar los cambios que experimenta el almidón durante la germinación de semillas de trigo. Se formula la hipótesis de que el almidón se degradará a azúcares reductores como la glucosa. El experimento involucra incubar semillas de trigo germinadas y una solución de almidón e identificar la presencia de almidón y azúcares a intervalos usando las pruebas de Lugol y Fehling.