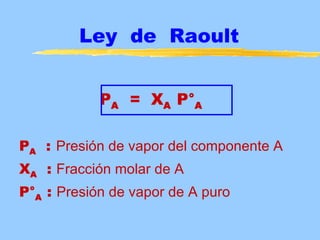
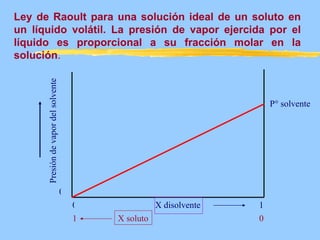
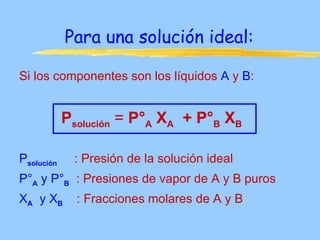
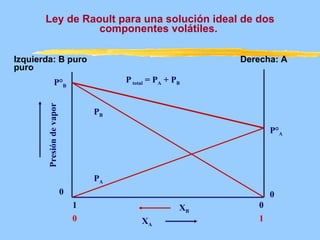
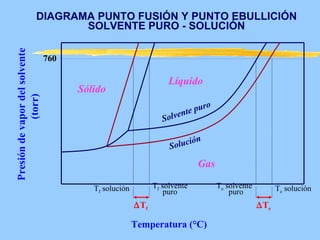
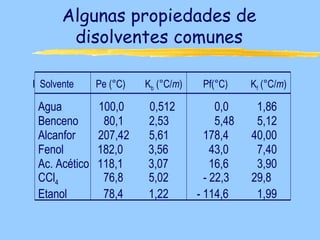
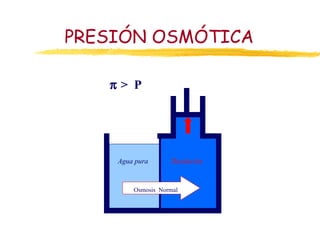
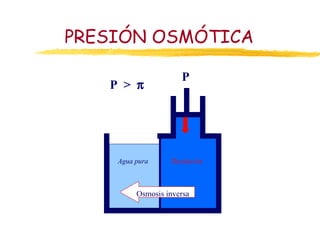
Este documento describe las propiedades coligativas de las soluciones, que son aquellas propiedades que dependen de la cantidad de soluto y no de su naturaleza. Las cuatro propiedades coligativas son: 1) Disminución de la presión de vapor, 2) Disminución del punto de congelación, 3) Aumento del punto de ebullición, y 4) Presión osmótica. Se explican las leyes y ecuaciones que rigen cada una de estas propiedades. También se dan ejemplos de cálculos relacionados con estas propied