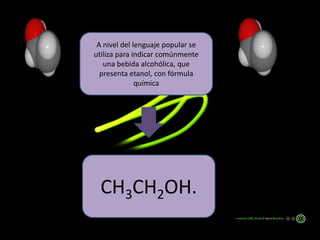
El documento describe las propiedades químicas del etanol. Explica que el etanol es un alcohol primario con la fórmula química CH3CH2OH. Se descubrió originalmente a través de la destilación de vino y ha sido estudiado por muchos químicos a través de los años. Los alcoholes tienen un grupo funcional hidroxilo y pueden comportarse como ácidos o bases débiles.