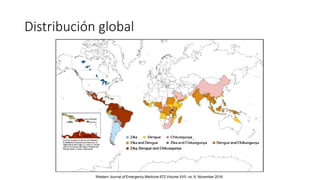
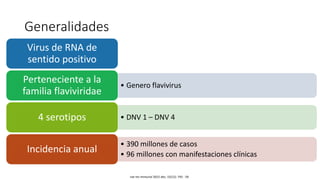
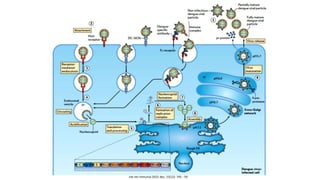
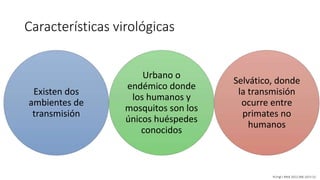
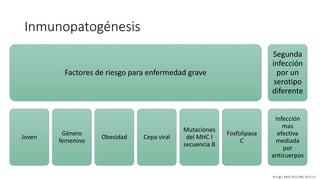
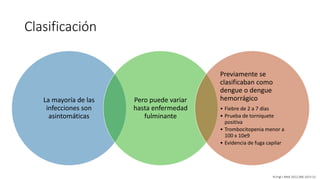
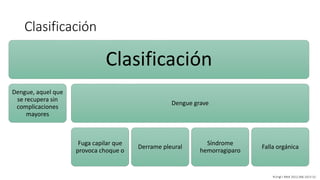
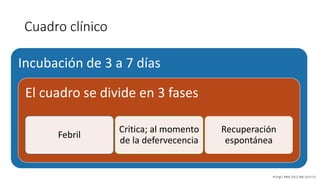
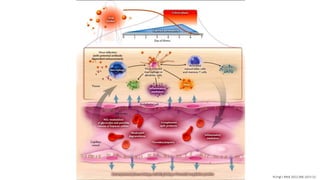
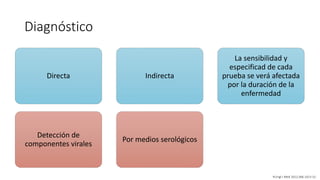
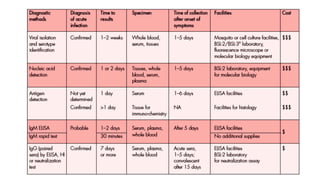
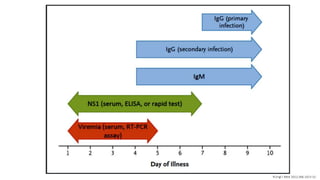
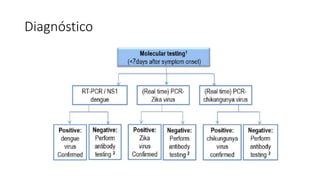
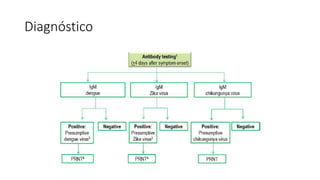
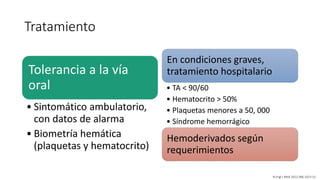
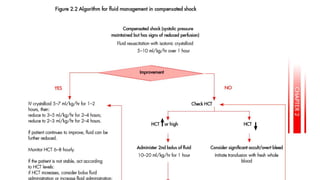
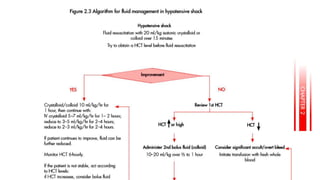
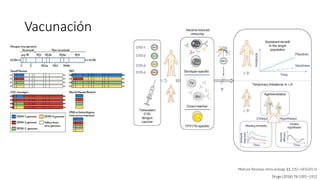
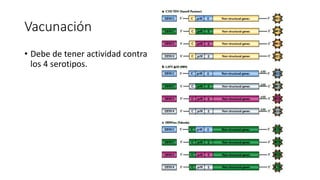
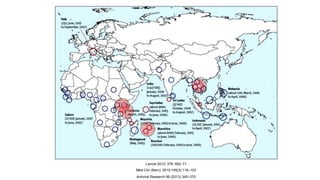
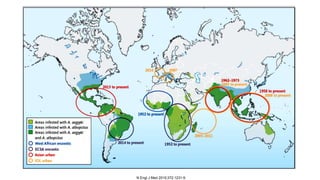
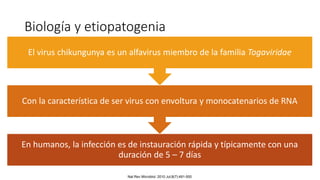
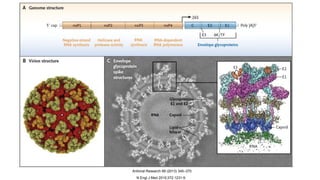
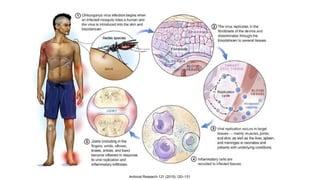
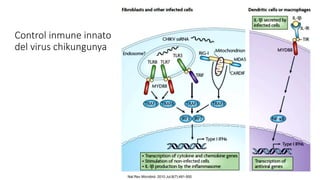
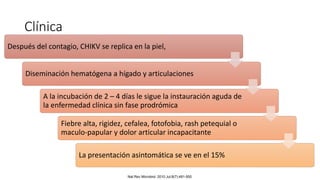
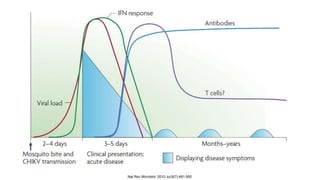
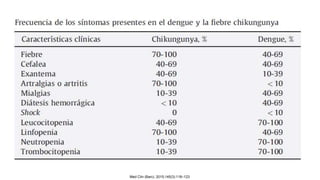
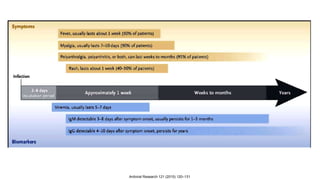
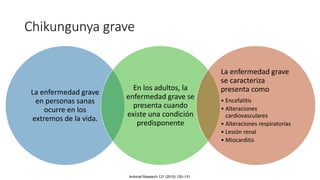
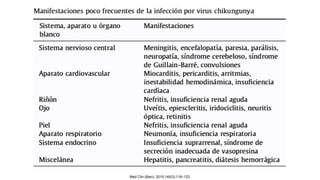
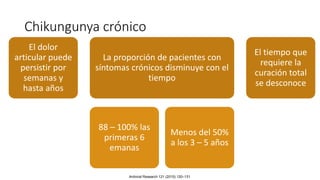
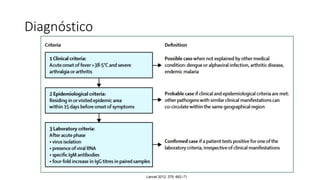
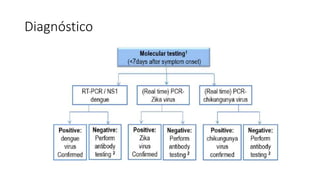
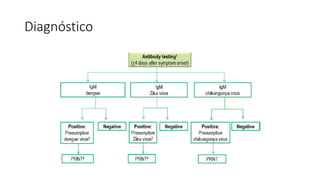
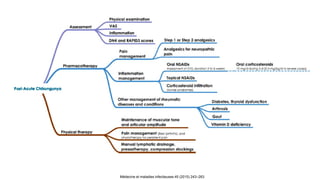
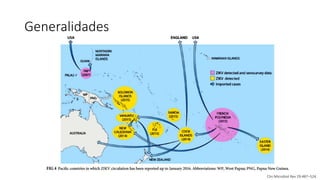
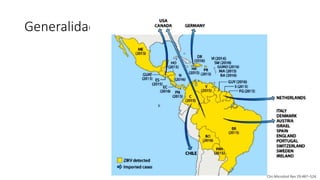
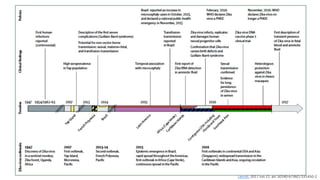
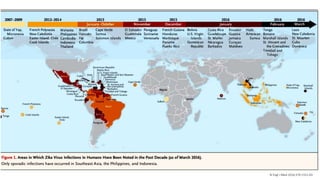
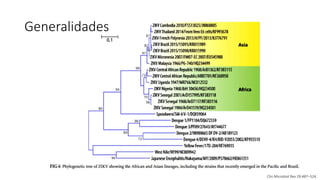
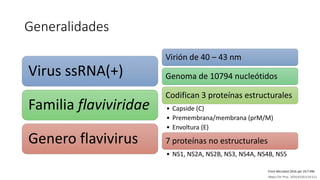
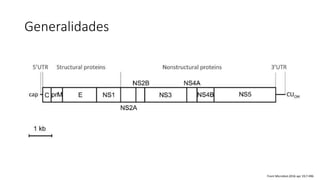
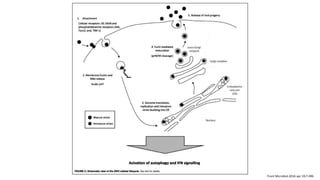
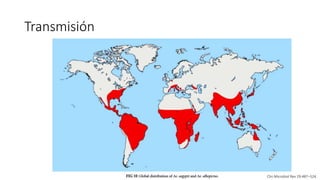
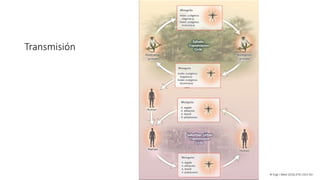
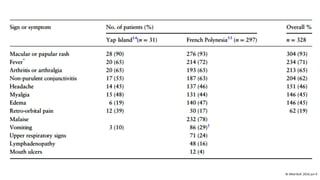
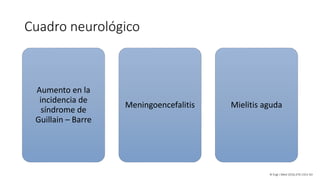
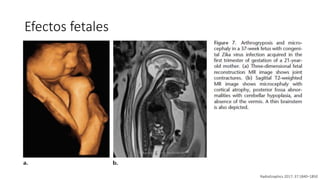
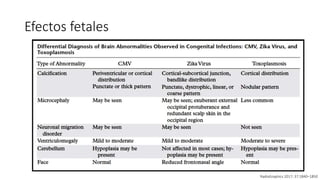
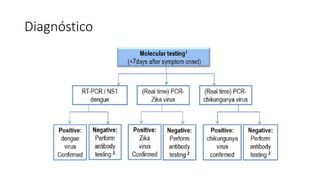
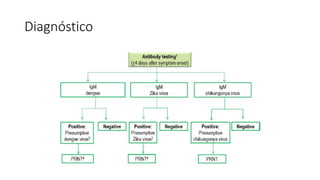
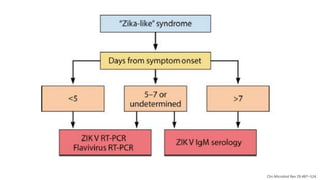
El documento aborda los arbovirus, enfocándose en el dengue, chikungunya y zika, describiendo su epidemiología, virología, cuadro clínico y diagnóstico. Se resalta la complejidad de las infecciones y sus manifestaciones, así como la necesidad de una vacuna efectiva para cada serotipo del dengue. Además, se menciona la implicación de estos virus en complicaciones graves, especialmente durante el embarazo y en poblaciones vulnerables.