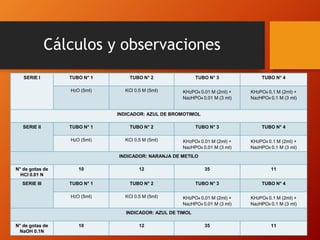
Esta práctica de laboratorio estudió soluciones amortiguadoras preparadas con fosfatos, carbonatos y acetatos. Los estudiantes prepararon tres series de tubos con diferentes soluciones y determinaron el pH agregando ácido o base. La Serie I mantuvo un pH neutro, mientras que la Serie II se volvió ácida y la Serie III alcalina. Algunas soluciones requirieron más ácido o base que otras para cambiar el pH, demostrando su capacidad amortiguadora.

![Cuestionario de prelaboratorio
1. Investigar que sustancias se requieren para preparar la solución
amortiguadora de fosfatos
Está compuesto por el hidrógeno fosfato (HPO4−2) y el dihidrógeno fosfato
(H2PO4).
2. Investigar que sustancias se emplean para preparar soluciones buffer
de carbonatos.
Consiste en el acido carbónico (H2CO3) y iones de carbonato de hidrógeno
(HCO3) en equilibrio.
3. Investigar cuáles son las sustancias que se emplean para preparar
soluciones buffer de acetatos.
Está compuesto por acido acético (C2H4O2) y acetato [C2H3O2]−](https://image.slidesharecdn.com/ppt-140525175049-phpapp02/85/Soluciones-amoritguadoras-2-320.jpg)