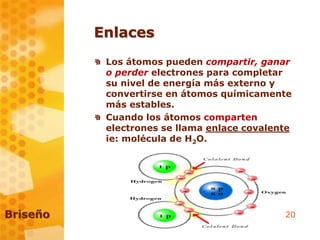
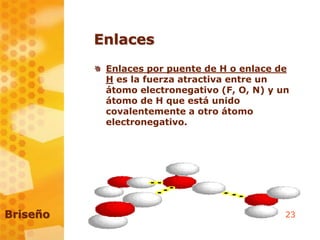
Este documento introduce conceptos básicos de bioquímica como átomos, masa atómica, número atómico, isótopos, iones y enlaces. Explica que la bioquímica estudia las estructuras y funciones de los seres vivos a nivel molecular. También cubre el código genético, síntesis de proteínas y transporte celular. Finalmente, discute la relación entre bioquímica, genética y biología molecular.