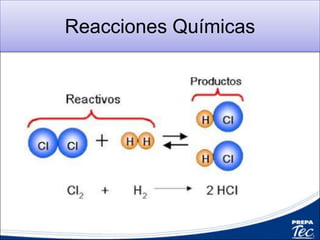
El documento proporciona información sobre reacciones químicas, incluyendo que un mol de metano y dos moles de oxígeno reaccionan para producir un mol de dióxido de carbono y dos moles de agua. También describe los tipos comunes de reacciones químicas como la síntesis, la descomposición y el desplazamiento, y explica cómo balancear ecuaciones químicas usando la ley de conservación de masa.